Cho 25 gam KMno4( có tạp chất) tác dụng với dung dịch HCl dư thu được khí clo đủ đẩy được i ốt ra khỏi dung dịch chứa 83 gam Kl. Độ tinh khiết của KMno4 đã dùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


- Theo bài ra \(\Rightarrow\left\{{}\begin{matrix}n_{KMnO_4}=0,1\\n_{KClO_3}=0,15\end{matrix}\right.\) ( mol )
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
.......0,1..........................................................0,25...........
\(KClO_3+6HCl\rightarrow KCl+3Cl_2+3H_2O\)
....0,15................................0,45....................
\(\Rightarrow n_{HCl}=0,7\left(mol\right)\)
\(6KOH+3Cl_2\rightarrow KClO_3+5KCl+3H_2O\)
Ta có : \(m=m_{KOH}+m_{Cl_2}=139,3\left(g\right)\)
Vậy ...

\(a,2KMnO_4+16HCl_{đặc}\rightarrow\left(t^o\right)2KCl+2MnCl_2+5Cl_2+8H_2O\\ 2Fe+3Cl_2\rightarrow\left(t^o\right)2FeCl_3\\ Ta.có:n_{FeCl_3}=\dfrac{39}{162,5}=0,24\left(mol\right)\\ n_{Fe}=n_{FeCl_3}=0,24\left(mol\right)\\ n_{Cl_2}=\dfrac{3}{2}.0,24=0,36\left(mol\right)\\ n_{K_2MnO_4}=\dfrac{2}{5}.0,36=0,144\left(mol\right)\\ n_{HCl}=\dfrac{16}{5}.0.36=1,152\left(mol\right)\\ \Rightarrow a=m_{KMnO_4}=0,144.158=22,752\left(g\right)\\ b=C_{MddHCl}=\dfrac{1,152}{0,1}=11,52\left(M\right)\\ x=m_{Fe}=0,24.56=13,44\left(g\right)\\ V=V_{Cl_2\left(đktc\right)}=0,36.22,4=8,064\left(l\right) \)
\(b,n_{KCl}=n_{MnCl_2}=\dfrac{2}{5}.0,36=0,144\left(mol\right)\\ KCl+AgNO_3\rightarrow AgCl\downarrow\left(trắng\right)+KNO_3\\ MnCl_2+2AgNO_3\rightarrow2AgCl\downarrow\left(trắng\right)+Mn\left(NO_3\right)_2\\ n_{AgNO_3}=n_{AgCl}=n_{KCl}+2.n_{MnCl_2}=0,144+2.0,144=0,432\left(mol\right)\\ \Rightarrow m_{AgCl\downarrow\left(trắng\right)}=143,5.0,432=61,992\left(g\right)\\ m_{AgNO_3}=0,432.170=73,44\left(g\right)\\ \Rightarrow m_{ddAgNO_3}=\dfrac{73,44.100}{5}=1468,8\left(g\right)\)

\(Fe^{2+} \to Fe^{3+} + 1e\\ Mn^{+7} + 5e \to Mn^{2+}\\ \Rightarrow n_{Fe^{2+}} = 5n_{KMnO_4} = 0,18.5 =0,9(mol)\\ 2FeCl_3 + Fe \to 3FeCl_2\\ n_{FeCl_3} = \dfrac{2}{3}n_{FeCl_2} = 0,6(mol)\\ n_{Fe\ pư} = \dfrac{1}{3}n_{Fe} = 0,3(mol)\\ \Rightarrow m_{Fe\ trong\ A} = 2,8 + 0,3.56 = 19,6(gam)\\ 2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3\\ n_{Fe} = n_{FeCl_3} = 0,6(mol)\\\)
Phần trăm khối lượng Fe tham gia phản ứng là : \(\dfrac{0,6.56}{0,6.56 + 19,6}.100\% = 63,15\%\)
a ơi nhưng trong đề của cô e cho 4 đáp án không có đáp án 63,15%

Đáp án B
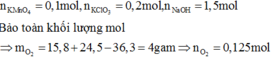
Khi cho hỗn hợp Y phản ứng với HCl đặc sẽ xảy ra phản ứng oxi hóa – khử tạo ra Cl2
![]()
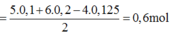

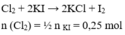
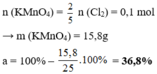
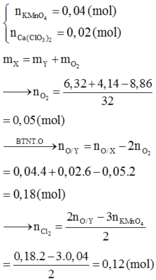


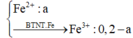
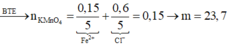
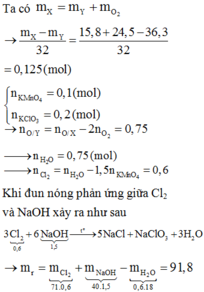
nKI = 83/166 = 0.5 (mol)
2KI + Cl2 => 2KCl + I2
0.5__0.25
2KMnO4 + 16HCl -to-> 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0.1_______________________________0.25
Độ tinh khiết của KMnO4 ; 0.1*158/25 * 100% = 63.2%
\(n_{KI} = \dfrac{83}{166}=0,5(mol)\\ 2KI + Cl_2 \to 2KCl + I_2\\ n_{Cl_2} = \dfrac{n_{KI}}{2} = 0,25(mol)\\ 2KMnO_4 + 16HCl \to 2KCl + 2MnCl_2 + 5Cl_2 + 8H_2O\\ n_{KMnO_4\ pư} = \dfrac{2}{5}n_{Cl_2} = 0,1(mol)\\ \text{Độ tinh khiết} : \%m_{KMnO_4} = \dfrac{0,1.158}{25}.100\% = 63,2\%\)