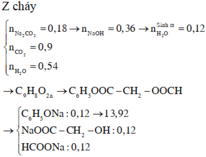
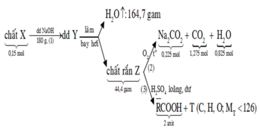
Cho 0,02 mol chất hữu cơ A (chứa 3 nguyên tố C , H , O) tác
dụng vừa đủ với 50 ml ddNaOH (khối lượng riêng 1,2 gam/ml) thu được dung dịch B . Làm bay hơi B thu được 58,76 gam hơi nước và còn lại 3,96 gam hỗn hợp các chất rắn khan D . Nếu đốt cháy hoàn toàn D thu được 2,12 gam Na2CO3 , 3,136 lít CO2 ở đktc và 1,44 gam H2O
Tìm CTPT của A ?


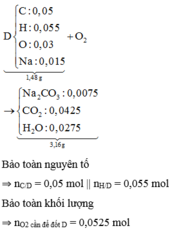

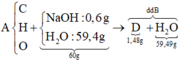
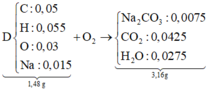
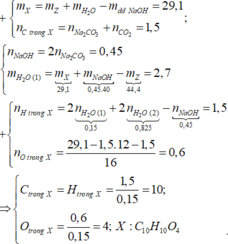
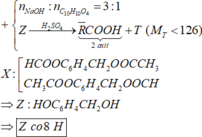
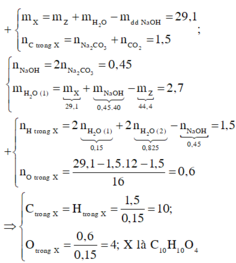

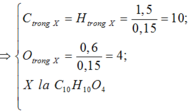
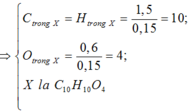
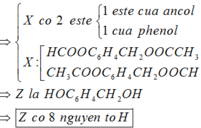
\(n_{Na_2CO_3}=\dfrac{2,12}{106}=0,02\left(mol\right)\)
\(n_{CO_2}=\dfrac{3,136}{22,4}=0,14\left(mol\right)\)
\(n_{H_2O}=\dfrac{1,44}{18}=0,08\left(mol\right)\)
Bảo toàn Na: nNaOH = nNa = 0,04 (mol)
=> \(m_{NaOH}=0,04.40=1,6\left(g\right)\)
mdd NaOH = 50.1,2 = 60(g)
=> mH2O(dd) = 60 - 1,6 = 58,4 (g)
=> Số mol H2O tạo ra khi cho 0,02 mol A tác dụng với NaOH là:
\(\dfrac{58,76-58,4}{18}=0,02\left(mol\right)\)
Bảo toàn C: nC(A) = 0,02 + 0,14 = 0,16 (mol)
Bảo toàn H: nH(A) = \(0,08.2+0,02.2-0,04=0,16\left(mol\right)\)
Bảo toàn khối lượng: \(m_{O_2}=2,12+0,14.44+1,44-3,96=5,76\left(g\right)\)
=> \(n_{O_2}=\dfrac{5,76}{32}=0,18\left(mol\right)\)
Bảo toàn O: nO(D) = 0,02.3 + 0,14.2 + 0,08 - 0,18.2 = 0,06 (mol)
=> nO(A) = 0,06 + 0,02 - 0,04 = 0,04 (mol)
Số nguyên tử C = \(\dfrac{0,16}{0,02}=8\)
Số nguyên tử H = \(\dfrac{0,16}{0,02}=8\)
Số nguyên tử O = \(\dfrac{0,04}{0,02}=2\)
=> CTPT: C8H8O2