Tính số mol các chất 22,4 gam fe
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(a,n_{Fe}=\dfrac{22,4}{56}=0,4(mol)\\ n_{H_2SO_4}=\dfrac{24,5}{98}=0,25(mol)\\ Fe+H_2SO_4\to FeSO_4+H_2\\ LTL:\dfrac{0,4}{1}>\dfrac{0,25}{1}\Rightarrow Fe\text{ dư}\\ n_{Fe(dư)}=0,4-0,25=0,15(mol)\\ \Rightarrow m_{Fe(dư)}=0,15.56=8,4(g)\\ \)
\(b,m_{dư}=m_{Fe(dư)}=8,4(g)\\ c,n_{H_2}=0,25(mol)\\ \Rightarrow V_{H_2}=0,25.22,4=5,6(l)\\ d,n_{FeSO_4}=0,25(mol)\\\Rightarrow m_{FeSO_4}=0,25.152=38(g)\)

a, Xin lỗi bạn ạ, mình không biết làm :((
b, VO2 = nO2 * 22,4 = 1 * 22,4 = 22,4 (lít)
VH2 = nH2 * 22,4 = 1,5 * 22,4 = 33,6 (lít)
VCO2 = nCO2 * 22,4 = 0,4 *22,4 =8,96 (lít)
c, nFe = mFe / MFe = 28/56 = 0,5 (mol)
nHCl = mHCl / MHCl = 36,5/36,5 = 1 (mol)
nC6H12O6 = mC6H12O6 / MC6H12O6 = 18/5352 = 0,003
Đây nha bạn !! :))

Đáp án D
Số mol Fe là: n F e = 22 , 4 56 = 0 , 4 ( m o l )
Số oxi hóa các nguyên tố thay đổi là: F e 0 + O 2 0 → t 0 F e 3 + 8 / 3 O 4 - 2
Quá trình nhường electron:
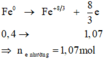

\(a,n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\\ PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ \text{Vì }\dfrac{n_{Fe}}{1}>\dfrac{n_{H_2SO_4}}{1}\text{ nên sau p/ứ }Fe\text{ dư}\\ \Rightarrow n_{H_2}=n_{H_2SO_4}=0,25\left(mol\right)\\ \Rightarrow V_{H_2\left(đktc\right)}=0,25\cdot22,4=5,6\left(l\right)\\ b,n_{Fe\left(dư\right)}=n_{Fe}-n_{Fe\left(\text{phản ứng}\right)}=0,4-0,25=0,15\left(mol\right)\\ \Rightarrow m_{Fe\left(dư\right)}=0,15\cdot56=8,4\left(g\right)\)

Đáp án C
nMg=0,3 mol; nFe=0,4 mol; nFe(NO3)3=0,5x mol; nCu(NO3)2=0,5y
Do Y gồm 2 kim loại (Cu, Fe) nên Mg hết, Fe dư, Fe(NO3)3 hết; Cu(NO3)2 hết
+ X gồm: 0,3 mol Mg(NO3)2 và a mol Fe(NO3)2
nNaOH=2nMg(NO3)2+2nFe(NO3)2=>2=2.0,3+2.a=>a=0,7mol
+ Y gồm (Cu: 0,5y mol; Fe dư: 0,5x+0,4-0,7=0,5x-0,3 mol) => 64.0,5y+56.(0,5x-0,3)=31,2 (1)
+ BTNT N: 3nFe(NO3)3+2nCu(NO3)2=2nMg(NO3)2+2nFe(NO3)2 => 3.0,5x+2.0,5y=2.0,3+2.0,7 (2)
Giải (1) và (2) => x=0,8M; y=0,8M
Giả sử chúng ta có hỗn hợp gồm 7,2 gam Mg và 22,4 gam Fe. Khi hòa tan hỗn hợp này trong dung dịch Fe(NO3)3 và Cu(NO3)2, ta thu được dung dịch X và 31,2 gam chất rắn Y gồm 2 kim loại.
Để tác dụng tối đa với dung dịch X, chúng ta cần dung dịch chứa 2,0 mol NaOH (không có không khí).
Chúng ta cần xác định giá trị của x và y.
Bước 1: Xác định số mol của Mg và Fe trong hỗn hợp ban đầu:
Số mol Mg: (n_{\text{Mg}} = \frac{{\text{khối lượng Mg}}}{{\text{khối lượng molecul Mg}}} = \frac{{7,2}}{{24,31}})Số mol Fe: (n_{\text{Fe}} = \frac{{\text{khối lượng Fe}}}{{\text{khối lượng molecu Fe}}} = \frac{{22,4}}{{55,85}})Bước 2: Xác định số mol của Fe(NO3)3 và Cu(NO3)2:
Số mol Fe(NO3)3: (n_{\text{Fe(NO3)3}} = x \times 0,5)Số mol Cu(NO3)2: (n_{\text{Cu(NO3)2}} = y \times 0,5)Bước 3: Xác định số mol của Mg(NO3)2 và Fe(NO3)2 sau phản ứng:
Số mol Mg(NO3)2: (n_{\text{Mg(NO3)2}} = n_{\text{Mg}} - n_{\text{Fe(NO3)3}})Số mol Fe(NO3)2: (n_{\text{Fe(NO3)2}} = n_{\text{Fe}} - n_{\text{Cu(NO3)2}})Bước 4: Xác định số mol của NaOH cần để tác dụng với Mg(NO3)2:
Số mol NaOH: (n_{\text{NaOH}} = 2,0)Bước 5: Xác định số mol của Mg(OH)2 sau phản ứng:
Số mol Mg(OH)2: (n_{\text{Mg(OH)2}} = n_{\text{Mg(NO3)2}})Bước 6: Tính giá trị của x:
(n_{\text{Mg(OH)2}} = n_{\text{Mg(NO3)2}})(n_{\text{Mg(OH)2}} = n_{\text{Mg}} - n_{\text{Fe(NO3)3}})(2,0 = \frac{{7,2}}{{24,31}} - x \times 0,5)Giải phương trình trên để tìm x.Bước 7: Tính giá trị của y:
(n_{\text{Cu(NO3)2}} = n_{\text{Fe}} - n_{\text{Fe(NO3)2}})(y \times 0,5 = \frac{{22,4}}{{55,85}} - x \times 0,5)Giải phương trình trên để tìm y.Sau khi tính toán, ta có:
(x \approx 0,8M)(y \approx 0,6M)Vậy giá trị của x và y là 0,8M và 0,6M

Đáp án B
4AgNO3 + 2H2O → d p d d 4Ag + 4HNO3 + O2
x → x (mol)
Dd X gồm: HNO3: x (mol); AgNO3 dư : 0,3 – x (mol)
Cho Fe vào dd X, sản phẩm thu được có Fe dư ( Vì mAg < 0,3. 108 < 34,28)
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
0,25x ← x → 0,25x
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
0,125x ←0,25x
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓
(0,15-0,5x)←(0,3-x)
∆m rắn tăng = mAg sinh ra – mFe pư
=> 34,28 – 22,4 = ( 0,3 – x). 108 – ( 0,25x + 0,125x + 0,15– 0,5x). 56
=> 11, 88 = 24-101x
=> x = 0,12 (mol)
=> nAg+ bị điện phân = 0,12 = It/F
=> t = 0,12. 96500/ 2,68 = 4320 (s) = 1,2 h

Khối lượng rắn sau phản ứng = 34,28g => mAg = 0,3*108 = 32,4
=> AgNO3 còn dư sau điện phân 2
AgNO3 + H2O ---> 2 Ag + 0,5 O2 + 2 HNO3x
---------------------x------------------x
Dung dịch sau phản ứng gồm AgNO3 dư 2y mol và HNO3 x mol
Fe + 2 AgNO3 --- Fe(NO3)2+ 2 Ag
y---------------2y---------y3
Fe + 8 HNO3 ----> 3 Fe(NO3)2 + 2 NO + 4 H2O3
x/8------x
số mol AgNO3 : x + 2y = 0,3
khối lượng rắn = 108*2y + 22,4 - 56*(y + 3x/8) = 34,28
=> x = 0,12 và y = 0,09
Thời gian t = 0,12*26,8*1/2,68 = 1,2 giờ
=> Đáp án C
Số mol của Fe là:
\(n_{Fe}=\dfrac{m}{M}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
......Γθλρδ