Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình điện phân: 4AgNO3 + 2H2O → 4Ag + O2 + 4HNO3 (1)
Dung dịch Y gồm: AgNO3, HNO3. Cho Fe + dd Y sau phản ứng thu được 14,5g hỗn hợp kim loại nên Fe dư có các phản ứng:
3Fe + 8HNO3 → 3Fe(NO3)3 + 2NO + 4H2O (2)
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (3)
Gọi x là số mol AgNO3 bị điện phân® nHNO3 = x, dung dịch Y: HNO3: x mol; AgNO3 dư: 0,15 –x mol.
Theo (2,3) nFe phản ứng = 3x/8 + (0,15-x)/2 = 0,075 –x/8 mol
nAg = 0,15 – x mol
Vậy mhỗn hợp kim loại = mFedư + mAg =12,6 –(0,075-x/8).56 +(0,15-x).108 =14,5
Suy ra: x= 0,1 mol. Ta có mAg = 0,1.108 ® t = 1,0 h

A. 184,1 gam và 91,8 gam.
B. 84,9 gam và 91,8 gam.
C. 184,1 gam và 177,9 gam.
D. 84,9 gam và 86,1 gam.

Cho m gam hỗn hợp X gồm ( Fe , FeO , Fe2O3 ) có tỷ lệ khối lượng tương ứng là 7:18:40 .Hỗn hợp X tan vừa hết trong 500 ml H2SO4 loãng 0,68 M thu được dung dịch B và thoát ra V lít khí H2 ( đktc). Cho dung dịch B tác dụng NaOH dư lọc kết tủa nung khô trong không khí thu được 22,4 gam chất rắn. Giá trị của V là ?
A. 0,448
B. 0,896
C. 2,24
D. 1,12

Đáp án B
Khối lượng chất rắn thu được sau phản ứng lớn hơn khối lượng Fe cho vào Þ Ag+ bị điện hân chưa hết
Catot Anot
Ag+ + 1e → Ag H2O - 2e → 2H+ + 0,5O2
x x x x → x


Đáp án B
Khối lượng chất rắn thu được sau phản ứng lớn hơn khối lượng Fe cho vào
=> Ag+ bị điện phân chưa hết
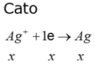
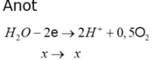
Dung dịch sau điện phân:
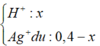
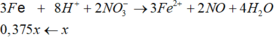
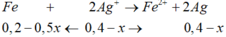
20,4 g chất rắn
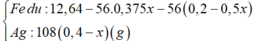
![]()
![]()
![]()
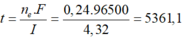

Phản ứng điện phân xảy ra ở các điện cực như sau:
Catot(-):Ag+ + e → Ag; Anot(+): H2O - 2e → 1/2O2 + 2H+
x x x (mol)
Dung dịch Y có chứa: H+, NO3- và Ag+ dư → Fe + 2Ag+ → 2Ag + Fe2+
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O (do Fe dư nên chỉ tạo Fe2+)
nAgNO3 = 0,15 mol; nFe = 12,6/56 = 0,225 mol;
Gọi x là số mol Ag+ đã bị điện phân → nAg+ dư = 0,15 – x mol → số mol Fe dư = 0,225 – (0,15-x)/2 – 3x/8 = 0,15 + x/8 → 108(0,15-x) + 56(0,15+x/8) = 14,5 → x = 0,1 mol → t = 0,1.26,8/2,68 = 1 h.

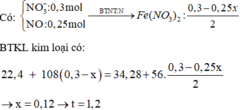
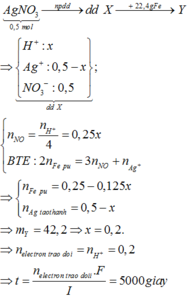
Đáp án B
4AgNO3 + 2H2O → d p d d 4Ag + 4HNO3 + O2
x → x (mol)
Dd X gồm: HNO3: x (mol); AgNO3 dư : 0,3 – x (mol)
Cho Fe vào dd X, sản phẩm thu được có Fe dư ( Vì mAg < 0,3. 108 < 34,28)
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
0,25x ← x → 0,25x
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
0,125x ←0,25x
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓
(0,15-0,5x)←(0,3-x)
∆m rắn tăng = mAg sinh ra – mFe pư
=> 34,28 – 22,4 = ( 0,3 – x). 108 – ( 0,25x + 0,125x + 0,15– 0,5x). 56
=> 11, 88 = 24-101x
=> x = 0,12 (mol)
=> nAg+ bị điện phân = 0,12 = It/F
=> t = 0,12. 96500/ 2,68 = 4320 (s) = 1,2 h