cho 16g hỗn hợp X gồm 2 kim loại Bari và R (có hoá trị không đổi) tác dụng hết với nước(dư) thu được 9.10^22 phân tử H2 . Mặt khác nếu đốt cháy 16g hỗn hợp X ở trên thì cần dùng V lít O2 (đktc).
a.Tính V
b.Tìm tên kim loại R . Biết rằng với cùng lượng kim loại R trong 16g trên cho tác dụng vừa đủ HCl(dư) thì tạo ra 1,12 lít H2(đktc)
ko chép mạng ạ

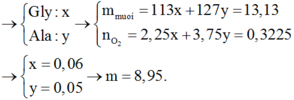
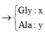
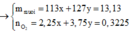
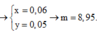

a, Theo gt ta có: $n_{H_2}=0,15(mol)$
Bảo toàn e ta có: $n_{e}=0,3(mol)\Rightarrow n_{O_2}=\frac{n_e}{4}=0,075(mol)$
$\Rightarrow V_{O_2}=1,68(l)$
b, Trường hợp 1: R không phải kiềm và kiềm thổ
$Ba+2H_2O\rightarrow Ba(OH)_2+H_2$
Ta có: $n_{Ba}=0,15(mol)\Rightarrow m_{R}=-4,55(g)$ (Loại)
Trường hợp 2: R là kiềm hoặc kiềm thổ
Ta có: $n_{R}=\frac{0,1}{n}(mol)$ (Với n là hóa trị của R)
Mặt khác $n_{Ba}+n_{R}.n:2=0,15\Rightarrow n_{Ba}=0,1(mol)\Rightarrow m_{R}=2,3$
Do đó $M_{R}=23n$
Vậy R là Na
Lớp 8 đã làm gì học bảo toàn e đâu m :<