Cho một khối lượng magie dư vào 200ml dd H2SO4. Sau phản ứng thu được 3,36 lít khí (đktc).
a) Tính khối lượng magie tham gia phản ứng.
b) Tính nồng độ mol của dung dịch H2SO4 đã dùng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Fe+H_2SO_4 \to FeSO_4+H_2\\ n_{H_2}=0,15(mol)\\ a/\\ n_{Fe}=n_{H_2}=0,15(mol)\\ m_{Fe}=0,15.56=8,4(g)\\ b/\\ n_{H_2SO_4}=n_{H_2}=0,15(mol)\\ CM_{H_2SO_4}=\dfrac{0,15}{2}=0,75M c/\\ n_{FeSO_4}=n_{H_2}=0,15(mol)\\ CM_{FeSO_4}=\dfrac{0,15}{0,2}=0,75M\\\)

a) \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
____0,15<--0,3<-------------0,15
=> mFe = 0,15.56 = 8,4 (g)
b) \(C_{M\left(ddHCl\right)}=\dfrac{0,3}{0,05}=6M\)

PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)=n_{Fe}=n_{H_2SO_4}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,15\cdot56=8,4\left(g\right)\\C\%_{H_2SO_4}=\dfrac{0,15\cdot98}{150}\cdot100\%=9,8\%\end{matrix}\right.\)

\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{3,36}{22,4}=0,15mol\)
a. PTHH: Fe + H2SO4 \(\rightarrow\) FeSO4 + H2
TL: 1 1 1 1
mol: 0,15 \(\leftarrow\) 0,15 \(\leftarrow\) 0,15 \(\leftarrow\) 0,15
\(b.m_{Fe}=n.M=0,15.56=8,4g\)
Đổi 150ml = 0,15 l
\(c.C_{MddH_2SO_4}=\dfrac{n}{V}=\dfrac{0,15}{0,15}=1M\)

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2(mol)\\ Fe+H_2SO_4\to FeSO_4+H_2\\ \Rightarrow n_{Fe}=n_{H_2SO_4}=n_{Fe(OH)_2}=0,2(mol)\\ a,m_{Fe}=0,2.56=11,2(g)\\ b,C_{M_{H_2SO_4}}=\dfrac{0,2}{0,2}=1M\)
\(c,Ba(OH)_2+FeSO_4\to BaSO_4\downarrow+Fe(OH)_2\downarrow\\ n_{Ba(OH)_2}=\dfrac{250.17,1}{100.171}=0,25(mol)\\ LTL:\dfrac{0,2}{1}<\dfrac{0,25}{1}\Rightarrow Ba(OH)_2\text{ dư}\\ \Rightarrow n_{BaSO_4}=0,2(mol)\\ \Rightarrow m_{BaSO_4}=233.0,2=46,6(g)\)

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a)PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
b) \(n_{Mg}=n_{H_2}=0,15\left(mol\right)\)
\(m_{Mg}=0,15.24=3,6\left(g\right)\)
c) \(n_{HCl}=2n_{H_2}=0,3\left(mol\right)\)
\(C_{M_{HCl}}=\dfrac{0,3}{0,5}=0,6\left(M\right)\)

a)
$Fe + H_2SO_4 \to FeSO_4 + H_2$
Theo PTHH :
$n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$m_{Fe} = 0,15.56 = 8,4(gam)$
b)
$n_{H_2SO_4} = n_{H_2} = 0,15(mol)$
$C_{M_{H_2SO_4}} = \dfrac{0,15}{0,05} = 3M$
c)
$n_{FeSO_4} = n_{H_2} = 0,15(mol)$
$C_{M_{FeSO_4}} = \dfrac{0,15}{0,05} = 3M$

a)
$Fe + 2HCl \to FeCl_2 + H_2$
b) Theo PTHH : $n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$m_{Fe} = 0,15.56 = 8,4(gam)$
c) $n_{HCl} = 2n_{H_2} = 0,3(mol)$
$\Rightarrow C_{M_{HCl}} = \dfrac{0,3}{0,05} = 6M$
d) $2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
$n_{H_2SO_4} = \dfrac{1}{2}n_{NaOH} = 0,25(mol)$
$m_{dd\ H_2SO_4} = \dfrac{0,25.98}{20\%} = 122,5(gam)$
$V_{dd\ H_2SO_4} = \dfrac{122,5}{1,14} = 107,5(ml)$
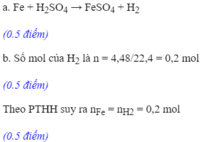

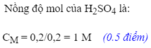
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\\ n_{Mg}=n_{H_2SO_4}=n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ a,m_{Mg}=0,15.24=3,6\left(g\right)\\ b,C_{MddH_2SO_4}=\dfrac{0,15}{0,2}=0,75\left(M\right)\)