Bài 3: Trộn 200ml dung dịch HC! 0, 1M với 100ml dung dịch H 2 SO 4 0,1M thu được dung dịch X. Tính pH của dung dịch X?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


H2SO4 và NaOH là các chất điện li mạnh nên điện li hoàn toàn thành ion.
nH2SO4 = 0,025 mol → nH+ = 2nH2SO4 = 0,05 mol
nNaOH = 0,02 mol → nOH- = nNaOH = 0,02 mol
PT ion: H+ + OH- → H2O
Ban đầu: 0,05 0,02 mol
Pư: 0,02 ← 0,02
Sau pư: 0,03 0 mol
→ [H+] = n/V = 0,03/(0,1 + 0,2) = 0,1M → pH = -log [H+] = 1

Đáp án C
nH+ = 0,02 mol; nOH-= 0,04 mol
H+ + OH- → H2O
0,02 0,04
nOH- dư = 0,02 mol; [OH-] dư = 0,02/0,2 = 0,1M suy ra [H+] = 10-13 M suy ra pH = 13

Đáp án B
nOH-= 0,03 mol; nBa2+ = 0,01 mol
nH+ = 0,035 mol; nSO4(2-) = 0,015 mol
H+ + OH- → H2O
0,035 0,03
nH+ dư = 5.10-3 mol; [H+] dư = 5.10-3/0,5 = 0,01 suy ra pH = 2
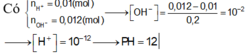
nHCl = 0,2.0,1 = 0,02 (mol)
nH2SO4 = 0,1.0,1 = 0,01 (mol)
=> nH+ = 0,02.1 + 0,01.2 = 0,04 (mol)
\(C_{M\left(H^+\right)}=\dfrac{0,04}{0,2+0,1}=0,1333M\)
=> pH = -log(0,1333) = 0,875