Dùng khí CO để khử 32g một oxit Sắt ở t\(^o\) cao , sau phản ứng thu được 22,4 g Fe và khí CO\(_2\) . Xác định CTHH của Oxit Sắt đó
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) \(n_O=\dfrac{34,8-25,2}{16}=0,6\left(mol\right)\)
=> \(n_{H_2O}=0,6\left(mol\right)\) (bảo toàn O)
=> \(n_{H_2}=0,6\left(mol\right)\) (bảo toàn H)
=> \(V_{H_2}=0,6.22,4=13,44\left(l\right)\)
b) \(n_{Fe}=\dfrac{25,2}{56}=0,45\left(mol\right)\)
nFe : nO = 0,45 : 0,6 = 3 : 4
=> CTHH: Fe3O4
c) \(m_{H_2O}=0,6.18=10,8\left(g\right)\)
Mà \(d_{H_2O}=1\left(g/ml\right)\)
=> \(V_{H_2O}=10,8\left(ml\right)\)

Đáp án B
Đặt công thức oxit sắt là FexOy
FexOy+ yCO → xFe + yCO2
nFe= 0,84/56= 0,015 mol
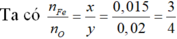
→Công thức oxit là Fe3O4
Ta có: nCO= nCO2= 0,02 mol
→ V= 0,02.22,4= 0,448 lít

a. áp dụng định luật bảo toàn nguyên tố
=> 4,8 g là khối lượng O trong oxit sắt
=> nO = 0,3 ; nFe = 0,2
CT oxit sắt là Fe2O3
b. Fe2O3 + 3CO ---> 2Fe + 3CO2
nCO = 0,3 mol
dùng dư 10% => nCO = 0,3 x 110% = 0,33 mol
CÂU C BN TỰ LM NHA, LƯỜI WÁ![]()
Gọi công thức oxit sắt:Fex0y.
Fex0y+yCO=>xFe+yC02
0.2/x------------>0.2(mol)
_Sau pư khối lượng chất rắn giảm 4.8 g so với ban đầu:
=>mFe=16-4.8=11.2(g)
=>nFe=11.2/56=0.2(mol)
=>n(Fex0y)=0.2/x(mol)
Mà nFex0y=16/(56x+16y) (mol)
=>16x=0.2(56x+16y)
<=>4.8x=3.2y
<=>x/y=2/3
Vậy công thức oxit sắt là Fe203.
_Khí sinh ra là C02 cho tác dụng với dd NaOH:
nC02=0.2*3=0.6(mol)
_Khối lượng dd tăng cũng chính là khối lượng C02 tham gia:
C02+2NaOH=>Na2S03+H20
0.6--->1.2-------->0.6(mol)
=>mC02=0.6*44=26.4(g)

Gọi số mol CO=mol CO2= a mol
Bảo toàn klg=>23,2+28a=44a+16,8
=>a=0,4 mol
=>VCO2=0,4.22,4=8,96 lit
Gọi CT oxit là Fe2On
Bảo toàn Fe: nFe tạo thành=nFe trong oxit ban đầu=16,8/56=0,3 mol
=>n oxit sắt=0,15 mol
=>M oxit sắt=23,2/0,15=464/3 =>n=8/3 CT oxit sắt là Fe3O4

\(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\\ n_O=\dfrac{11,6-0,15}{16}=0,2\left(mol\right)\)
CTHH: FexOy
\(\rightarrow x:y=n_{Fe}:n_O=0,15:0,2=3:4\)
CTHH: Fe3O4
PTHH: Fe3O4 + 4H2 --to--> 3Fe + 4H2O
0,2 0,15
=> VH2 = 0,2.22,4 = 4,48 (l)
\(n_{Fe}=\dfrac{8,4}{56}=0,15mol\)
\(n_{Fe_xO_y}=\dfrac{11,6}{56x+16y}\) mol
\(Fe_xO_y+yH_2\rightarrow\left(t^p\right)xFe+yH_2O\)
\(\dfrac{11,6}{56x+16y}\) \(\dfrac{11,6x}{56x+16y}\) ( mol )
\(\Rightarrow\dfrac{11,6x}{56x+16y}=0,15\)
\(\Leftrightarrow11,6x=8,4x+2,4y\)
\(\Leftrightarrow3,2x=2,4y\)
\(\Leftrightarrow4x=3y\)
\(\Leftrightarrow x=3;y=4\)
\(\Rightarrow CTHH:Fe_3O_4\)
\(\Rightarrow n_{H_2}=0,15.4:3=0,2mol\)
\(V_{H_2}=0,2.22,4=4,48l\)

PTHH: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
a+b) \(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Fe_2O_3}=0,2\left(mol\right)\\n_{H_2}=0,6\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe_2O_3}=0,2\cdot160=32\left(g\right)\\V_{H_2}=0,6\cdot22,4=13,44\left(l\right)\end{matrix}\right.\)
c) PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
Theo PTHH: \(n_{Zn}=n_{H_2}=0,6\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,6\cdot65=39\left(g\right)\)
a,
nFe = 22,4/56 = 0,4 (mol)
PTHH
Fe2O3 + 3H2 ---to----) 2Fe + 3H2O (1)
theo phương trình (1) ,ta có:
nFe2O3 = 0,4 x 2 / 1 = 0,8 (mol)
mFe2O3 = 160 x 0,8 = 128 (g)
b,
theo pt (1)
nH2 = (0,4 x 3)/2 = 0,6 (mol)
=) VH2 = 0,6 x 22,4 = 13,44 (L)
c,
PTHH
Zn + H2SO4 -------------) ZnSO4 + H2 (2)
Số mol H2 cần dùng là 0,6 (mol)
Theo PT (2) :
nZn = nH2 ==) nZn = 0,6 x 65 = 39 (g)

Oxit : FexOy
\(n_{Fe} = \dfrac{22,4}{56} = 0,4(mol)\\ Fe_xO_y + yH_2 \xrightarrow{t^o} xFe + yH_2O\\ \Rightarrow n_{oxit} = \dfrac{n_{Fe}}{x} = \dfrac{0,4}{x}\ mol\\ \Rightarrow \dfrac{0,4}{x}(56x+16y) = 32\\ \Rightarrow \dfrac{x}{y} = \dfrac{2}{3}\)
Vậy CTHH của oxit : Fe2O3
cảm ơn nhiều ạ