Hòa tan hoàn toàn 1,88 g gam K2O vào 500 ml nước thu được dung dịch A (coi như thể tích không thay đổi). a.Viết phương trình phản ứng? b.Tính nồng độ mol của dung dịch thu được sau phản ứng? bTính khối lượng dung dịch HCl 7,3 % cần dùng để trung hòa hết 50% lượng dung dịch A ở trên.?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Fe}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=5,6\left(g\right)\)
\(\Rightarrow m_{Fe_2O_3}=16\left(g\right)\)
\(\Rightarrow n_{Fe}=2n_{Fe_2O_3}=0,2\left(mol\right)=n_{FeCl_3}\)
Lại có : \(n_{HCl}=2n_{H_2}+3n_{FeCl_3}=0,8\left(mol\right)\)
\(\Rightarrow m_{ddHCl}=292\left(g\right)\)
\(\Rightarrow V=\dfrac{2920}{11}\left(ml\right)=\dfrac{73}{275}\left(l\right)\)
\(\Rightarrow C_{MFeCl_3}=\dfrac{0,2}{\dfrac{73}{275}}=\dfrac{55}{73}\left(M\right)\)

a)\(n_{HCl}=0,5\cdot1=0,5mol\)
PT: \(2R+2nHCl\rightarrow2RCl_n+nH_2\)
\(n_R=\dfrac{4,05}{M_R}\)
\(n_{H_2}=\dfrac{5,04}{22,4}=0,225mol\)
\(\Rightarrow\dfrac{4,05}{M_R}\cdot n=0,225\cdot2\)
R là kim loại:
\(\begin{matrix}n&1&2&3\\M_R&9&18&27\end{matrix}\)
Vậy R có hóa trị III và \(M_R=27\left(Al\right)\)
b)PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,15 0,5 0,225
0,15 0,45 0,15 0,225
Vậy \(C_{M_{AlCl_3}}=\dfrac{0,15}{0,5}=0,3M\)

a) PTHH: \(SO_3+H_2O\rightarrow H_2SO_4\)
Ta có: \(n_{SO_3}=\dfrac{24}{80}=0,3\left(mol\right)=n_{H_2SO_4}\) \(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,3\cdot98}{20\%}=147\left(g\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{147}{1,14}\approx128,95\left(ml\right)\)
b) PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Theo PTHH: \(n_{Fe}=n_{H_2SO_4}=n_{H_2}=0,3\left(mol\right)=n_{FeSO_4}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,3\cdot56=16,8\left(g\right)\\V_{H_2}=0,3\cdot24,76=7,428\left(l\right)\\m_{FeSO_4}=0,3\cdot152=45,6\left(g\right)\\m_{H_2}=0,3\cdot2=0,6\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{Fe}+m_{ddH_2SO_4}-m_{H_2}=163,2\left(g\right)\)
\(\Rightarrow C\%_{FeSO_4}=\dfrac{45,6}{163,2}\cdot100\%\approx27,94\%\)

a) \(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,4-->0,6---------->0,2------->0,6
=> \(C_{M\left(dd.H_2SO_4\right)}=\dfrac{0,6}{0,15}=4M\)
b) VH2 = 0,6.22,4 = 13,44 (l)
c) \(C_{M\left(Al_2\left(SO_4\right)_3\right)}=\dfrac{0,2}{0,15}=\dfrac{4}{3}M\)
\(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\\
pthh:2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,4 0,6 0,2 0,6
\(C_M_{H_2SO_4}=\dfrac{0,6}{0,15}=4M\\ V_{H_2}=0,622,4=13,44L\)
\(C_M=\dfrac{0,2}{0,15}=1,3M\)

Chọn D
Gọi số mol của FeO và CuO lần lượt là x và y mol
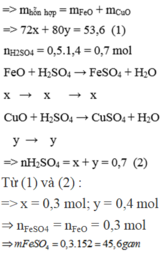
Ta có: m d d H 2 S O 4 = D . V = 1 , 2 . 500 = 600 g a m
Vì phản ứng không tạo ra chất khí hay kết tủa nên:
m d d s a u p ư = m t r ư ớ c p ư = m h h A + m d d a x i t = 53 , 6 + 600 = 653 , 6 g a m .
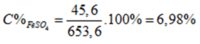

a)
$n_{CaCO_3} = 0,12(mol) ; n_{HCl} = 0,6(mol)
\(CaCO_3+2HCl\text{→}CaCl_2+CO_2+H_2O\)
Ban đầu 0,12 0,6 (mol)
Phản ứng 0,12 0,24 (mol)
Sau pư 0 0,36 0,12 (mol)
$V = 0,12.22,4 = 2,688(lít)$
b)
$n_{Cl^-} = 0,6(mol) ; n_{H^+} = 0,36(mol)$
$n_{Ca^{2+}} = 0,12(mol)$
$[Cl^-] = \dfrac{0,6}{0,2} = 3M$
$[H^+] = \dfrac{0,36}{0,2} = 1,8M$
$[Ca^{2+}] = \dfrac{0,12}{0,2} = 0,6M$
a,\(n_{CaCO_3}=\dfrac{12}{100}=0,12\left(mol\right);n_{HCl}=0,2.3=0,6\left(mol\right)\)
PTHH: CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Mol: 0,12 0,12
Ta có: \(\dfrac{0,12}{1}< \dfrac{0,6}{2}\)⇒ HCl dư,CaCO3 pứ hết
\(V_{CO_2}=0,12.22,4=2,688\left(l\right)\)


\(n_{K_2O}=\dfrac{1,88}{94}=0,02(mol)\\ a,K_2O+H_2O\to 2KOH\\ b,n_{KOH}=0,04(mol)\\ \Rightarrow C_{M_{KOH}}=\dfrac{0,04}{0,5}=0,08M\\ c,n_{KOH}=0,04.50\%=0,02(mol)\\ KOH+HCl\to KCl+H_2O\\ \Rightarrow n_{HCl}=0,02(mol)\\ \Rightarrow m_{dd_{HCl}}=\dfrac{0,02.36,5}{7,3\%}=10(g)\)