Cho 1(g) bột sắt tiếp xúc với oxi một thời gian thấy khối lượng bột sắt đã vượt lên 1,39(g). Nếu chỉ tạo thành 1 oxit duy nhất thì đó có thể là oxit nào?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


m tăng= mO= 1,39-1= 0,39g
\(\rightarrow\) nO= \(\frac{0,39}{16}\)= 0,02 mol
nFe=\(\frac{1}{56}\)= 0,02 mol
nFe: nO= 0,02: 0,02= 1:1
Vậy oxit sắt là FeO

\(n_{Fe}=\frac{1}{56}\left(mol\right)\)
PT: \(xFe+\frac{y}{2}O_2-to->Fe_xO_y\)
theo PT ta có:
\(n_{Fe_xO_y}=\frac{1}{56}x\left(mol\right)\)
=> \(m_{Fe_xO_y}=\frac{1}{56}x.\left(56x+16y\right)>1,4\)
=> \(\frac{16y}{56x}>1,41\)
=> \(\frac{y}{x}>0,41:\frac{16}{56}=1,435\)
=> chọn \(x=2,y=3\) là thỏa mãn
=> oxit đó là: \(Fe_2O_3\)
Khi sắt tiếp xúc với oxi sẽ bị oxi hóa nên khối lượng sắt tăng lên là khối lượng oxi.
=> MO = 1,41 - 1 = 0,41 g
Đặt CT oxit là FexOy
Tỉ số : \(\frac{56x}{m_{Fe}}=\frac{16y}{m_O}\Leftrightarrow\frac{56x}{1}=\frac{16y}{0,41}\Leftrightarrow\frac{x}{y}\approx\frac{2}{3}\)
=> x = 2 ; y = 3
Vậy công thức oxit là Fe2O3

3Fe+2O2-to>Fe3O4
Áp dụng định luật bảo toàn khối lượng :
mFe+mO2=mFe3O4
=>mFe3O4=4,2+1,6=5,8g
mgfe + mgo2 = fe3o4
4,2g +1,6g = fe3o4
5,8g =fe3o4
vậy khối lg sắt từ tạo ra là 5,8g

a,3Fe +2O2→to→Fe3O4
b,CT:m=n.M
c, Số mol Fe là: nFe=8,4/56=0,15 mol
Theo pt:nFe3O4=nFe=0,15 mol
Khối lượng Fe3O4: mFe3O4=n.M=0,15.232=34,8
d,Số mol O2 pư là:nO2=2/3 . 0,15=0,1 mol
Khối lượng O2 phản ứng là:m=0,1.32=3,2 g
khối lượng kk cần dùng là: 3,2:21%=15,238g

nFe=8.4/56=0.15(mol)
nO2=2.24/22.4=0.1(mol) ( đề bài chắc ghi sai 2.24lít thành 2.24gam nhỉ)
PTHH:
3Fe + 2O2 -->(nhiệt độ) Fe3O4
B/đ`:0.15 0.1 0 (mol)
P/ứ: 0.15-->0.1--> 0.05(mol)
SauP/ứ:0 0 0.05 (mol)
=> sau phả ứng thu được 0.05 mol Fe3O4
=>mFe3O4=0.05*232=11.69g)
Ta có: \(n_{Fe}=\frac{8,4}{56}=0,15\left(mol\right)\\ n_{O_2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: 3Fe + 2O2 -to-> Fe3O4
Theo các PTHH và đề bài, ta có:
\(\frac{0,15}{3}=\frac{0,1}{2}\)
=> Không có chất nào dư nên ta tính theo chất nào cũng được.
=> \(n_{Fe_3O_4}=\frac{0,1}{2}=0,05\left(mol\right)\\ =>m_{Fe_3O_4}=232.0,05=11,6\left(g\right)\)

Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{O_2}=b\left(mol\right)\end{matrix}\right.\)
=> 56a + 32b = 15,84
nO(oxit) = nCO = 0,22 (mol)
=> 2b = 0,22
=> b = 0,11 (mol)
=> a = 0,22 (mol)
2Fe0 -6e --> Fe2+3
0,22->0,66
O20 + 4e --> 2O-2
0,11->0,44
S+6 + 2e --> S+4
2nSO2 <-nSO2
Bảo toàn e: 2nSO2 + 0,44 = 0,66
=> nSO2 = 0,11 (mol)
=> \(V_{SO_2}=0,11.22,4=2,464\left(l\right)\)
=> D
okok, vậy bn có thể lm nnay nhé
bn thử check lại xem ở mA là 15,48g hay 15,84g
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{O_2}=b\left(mol\right)\end{matrix}\right.\)
=> 56a + 32b = 15,84
nO(oxit) = nCO = 0,22 (mol)
=> 2b = 0,22
=> b = 0,11 (mol)
=> a = 0,22 (mol)
\(Fe+O_2\rightarrow A\left\{{}\begin{matrix}Fe\\FeO\\Fe_2O_3\\Fe_3O_4\end{matrix}\right.+H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+SO_2+H_2O\)
- Nếu là 15,84g
Gọi số mol SO2 là a (mol)
Bảo toàn Fe: \(n_{Fe_2\left(SO_4\right)_3}=0,11\left(mol\right)\)
Bảo toàn S: \(n_{H_2SO_4}=3.0,11+a=0,33+a\left(mol\right)\)
Bảo toàn H: \(n_{H_2O}=0,33+a\left(mol\right)\)
Theo ĐLBTKL: \(m_A+m_{H_2SO_4}=m_{Fe_2\left(SO_4\right)_3}+m_{SO_2}+m_{H_2O}\)
=> 15,84 + 98(0,33+a) = 0,11.400 + 64a + 18(0,33+a)
=> a = 0,11
=> VSO2 = 0,11.22,4 = 2,464 (l)
=> D

Đáp án A
Ta có sơ đồ phản ứng:
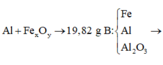
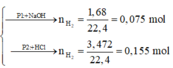
Phần 1:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
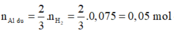
![]()
Phần 2:
2Al + 6HCl → 2AlCl3 + 3H2↑ (1)
0,05 → 0,075
Fe + 2HCl → FeCl2 + H2↑ (2)
![]()
![]()
![]()
![]()
Ta có phương trình phản ứng:
![]()
Khối lượng các chất trong 1 phần hỗn hợp B là 19,82/2 = 9,91 g
![]()
![]()
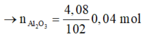
Ta có:
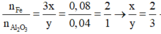
=> Oxit sắt cần tìm là Fe2O3

\(m_{tăng}=m_O=1.39-1=0.39\left(g\right)\)
\(CT:Fe_xO_y\)
\(\)\(n_{Fe}=\dfrac{1}{56}\simeq0.02\left(mol\right)\)
\(n_O=\dfrac{0.39}{16}\simeq0.02\left(mol\right)\)
\(x:y=n_{Fe}:n_O=0.02:0.02=1:1\)
\(CT:FeO\)
Đề: Cho 1(g) bột sắt tiếp xúc với oxi một thời gian thấy khối lượng bột sắt đã vượt lên 1,39(g). Nếu chỉ tạo thành 1 oxit duy nhất thì đó có thể là oxit nào?
Trả lời:
m tăng= mO= 1,39-1= 0,39g
nO= 0,39/16= 0,02 mol
nFe= 1/56= 0,02 mol
nFe: nO= 0.02:0,02= 1:1 nên oxit sắt là FeO