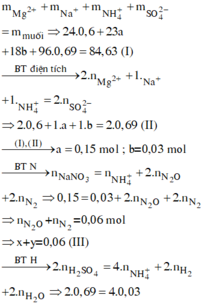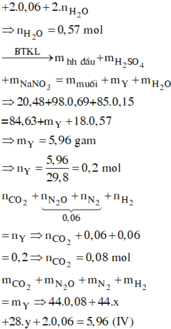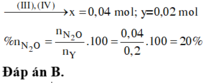Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Hơi muộn nhé, lần sau bạn đăng sớm hơn chứ hầu hết giờ nay mọi người đi ngủ rồi, chúc bạn thi tốt nhé ^^
a) Gọi \(\left\{{}\begin{matrix}n_{MgCO_3}=a\left(mol\right)\\n_{CaCO_3}=b\left(mol\right)\end{matrix}\right.\)
\(n_{CO_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
PTHH:
MgCO3 + 2CH3COOH ---> (CH3COO)2Mg + CO2 + H2O
a---------->2a-------------------->a----------------->a
CaCO3 + 2CH3COOH ---> (CH3COO)2Ca + CO2 + H2O
b---------->2b------------------>b------------------>b
=> \(\left\{{}\begin{matrix}84a+100b=31,8\\a+b=0,35\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,2\left(mol\right)\\b=0,15\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}m_{MgCO_3}=0,2.84=16,8\left(g\right)\\m_{CaCO_3}=0,15.100=15\left(g\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%m_{MgCO_3}=\dfrac{16,8}{31,8}.100\%=52,8\%\\\%m_{CaCO_3}=100\%-52,8\%=47,2\%\end{matrix}\right.\)
b) \(V_{dd}=\dfrac{2.0,2+2.0,15}{2}=0,35\left(l\right)\)
c) \(m_{muối}=0,2.142+0,15.158=52,1\left(g\right)\)

MgCO3 + 2HCl → MgCl2 + CO2 + H2O
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Giả sử hỗn hợp X chỉ có muối MgCO3
→ nX = 31,8/84 = 0,379 mol
Giả sử hỗn hợp X chỉ có muối CaCO3
→ nX = 31,8/100 = 0,318 mol
Như vậy, 31,8 gam hỗn hợp X gồm MgCO3 và CaCO3 sẽ có số mol nằm trong khoảng: 0,318 < nX < 0,379
→ Số mol HCl tối đa để phản ứng hết với 31,8 gam X sẽ < 2.0,379 = 0,758 mol.
Số mol HCl đề bài cho = 0,8 mol > 0,758 mol. Như vậy, dung dịch Z vẫn còn dư axit.
b)
0,318 < nCO2 < 0,379
c)
HCl + NaHCO3 → NaCl + CO2 + H2O
nHCl dư = nCO2 = 0,1 mol
Như vậy nHCl đã phản ứng với X = 0,7 mol
Gọi a, b lần lượt là số mol của MgCO3 và CaCO3 có trong 31,8 gam hỗn hợp X
→ 84a + 100b = 31,8
nHCl = 2a + 2b = 0,7 mol
Giải ra: a =0,2 mol và b = 0,15 mol

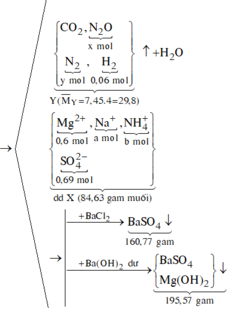
Đáp án B
Giả sử hỗn hợp chỉ gồm ![]()
hỗn hợp chỉ gồm : ![]()
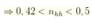 do đó HCl luôn dư
do đó HCl luôn dư
![]()

Đáp án D
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH giải phóng khí H2 => X chứa A dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02 ← 0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29 ← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol) => nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)

Giải thích:
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH Giải phóng khí H2 => X chứa A dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02 ← 0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29 ← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol) => nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)
Đáp án D

Đáp án D
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH giải phóng khí H2 => X chứa A dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02 ← 0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29 ← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol) => nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)