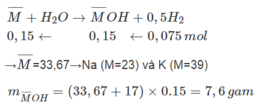Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nHCl=0.03 mol
=>n kim loại = nOH- = nHCl =0.03 mol
M=0.85/0.03=28.33 => Na và K
Gọi a là số mol Na, b là số mol K
a+b=0.03
23a + 39b=0.85
=>a=0.02, b=0.01
số mol H2 tạo thành =0.03/2=0.015 mol
mdd A=0.85+49.18-0.015*2=50g
%NaOH=1.6%, %KOH=1.12%
nHCl=0.03 mol
=>n kim loại = nOH- = nHCl =0.03 mol
M=0.85/0.03=28.33 => Na và K
Gọi a là số mol Na, b là số mol K
a+b=0.03
23a + 39b=0.85
=>a=0.02, b=0.01
số mol H2 tạo thành =0.03/2=0.015 mol
mdd A=0.85+49.18-0.015*2=50g
%NaOH=1.6%, %KOH=1.12%

a, \(n_{H_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
BT e, có: nR = 2nH2 = 0,2 (mol)
\(\Rightarrow\overline{M}_R=\dfrac{5,4}{0,2}=27\left(g/mol\right)\)
Mà: 2 KL thuộc 2 chu kì liên tiếp và thuộc nhóm IA.
→ Na và K.
b, Có: 23nNa + 39nK = 5,4 (1)
BT e, có: nNa + nK = 2nH2 = 0,2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Na}=0,15\left(mol\right)\\n_K=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Na}=\dfrac{0,15.23}{5,4}.100\%\approx63,89\%\\\%m_K\approx36,11\%\end{matrix}\right.\)
b, BTNT H, có: \(n_{H_2SO_4\left(pư\right)}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,1.20\%=0,02\left(mol\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{0,1+0,02}{1}=0,12\left(l\right)\)
BTNT Na, có: nNa2SO4 = 1/2.nNa = 0,075 (mol)
BTNT K, có: nK2SO4 = 1/2.nK = 0,025 (mol)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0,02}{0,12}=\dfrac{1}{6}\left(M\right)\\C_{M_{Na_2SO_4}}=\dfrac{0,075}{0,12}=0,625\left(M\right)\\C_{M_{K_2SO_4}}=\dfrac{0,025}{0,12}=\dfrac{5}{24}\left(M\right)\end{matrix}\right.\)

Coi hai nguyên tố là R \(\Rightarrow\overline{M}=M_R\)
a, PTHH:
\(2R+2H_2O\rightarrow2ROH+H_2\uparrow\)
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\Rightarrow n_R=2n_{H_2}=0,3\left(mol\right)\)
Khi đó \(\overline{M}=M_R=\dfrac{9,3}{0,3}=31\left(g/mol\right)\)
\(\Rightarrow\) Hai nguyên tố lần lượt là Na, K
b, PTHH:
\(2ROH+H_2SO_4\rightarrow R_2SO_4+2H_2O\)
\(\Rightarrow n_{H_2SO_4}=\dfrac{1}{2}n_{ROH}=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{n_{H_2SO_4}}{C_M}=\dfrac{0,15}{2}=0,075\left(l\right)\)
\(n_{R_2SO_4}=n_{H_2SO_4}=0,15\left(mol\right)\)
\(\Rightarrow m_{R_2SO_4}=0,15.\left(31.2+32+16.4\right)=23,7\left(g\right)\)

Đáp án C
nAl = 0,06 (mol) ; nHNO3 = 0,28 (mol)
BT e: ne (Al nhường) = 0,06. 3 = 0,18 < n e (N+5 nhận ) = (0,28: 4). 3 = 0,21
=> nHNO3 dư = 0,28 – 4nNO = 0,28 – 4. 0,06 = 0,04 (mol)
Vậy dd X thu được gồm: Al3+ : 0,06 mol ; H+ : 0,04 mol; NO3- : 0,22 mol
nH2 = 0,125 (mol) => n e (KL kiềm nhận) = 2nH2 = 0,25 (mol)
Khi cho KL kiềm + axit thiếu thì khi phản ứng hết với axit KL sẽ tiếp tục phản ứng với H2O để tạo thành dd bazơ
=> dd Y thu được phải chứa OH- : y (mol); ( y < 0,25 mol)
Trộn X + Y → nAl(OH)3 ↓ = 0,02 (mol) xảy ra các PTHH sau:
H+ + OH - → H2O
0,04→ 0,04
Al3+ + 3OH- → Al(OH)3
0,06 ← 0,02
=> ∑ nOH- = 0,04 + 0,06 = 0,1 (mol) = y
=> nHCl = 0,25 – 0,1 = 0,15 (mol) => CM = 0,15 : 0,5 = 0,3 (M)

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1mol\)
\(2X+H_2SO_4\rightarrow X_2SO_4+H_2\)
0,2 \(\leftarrow\) 0,1
\(\Rightarrow\overline{M_X}=\dfrac{5,4}{0,2}=27\) \(\Rightarrow X_1< 27< X_2\)
Mà X1, X2 thuộc nhóm IA
\(\Rightarrow\left\{{}\begin{matrix}X_1:Na\\X_2:K\end{matrix}\right.\) Gọi \(n_{Na}=x\left(mol\right)\) , \(n_K=y\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}BTKL:23x+39y=5,4\\BTe:x+y=2n_{H_2}=0,2\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}x=0,15mol\\y=0,05mol\end{matrix}\right.\)
\(\%m_{Na}=\dfrac{0,15\cdot23}{5,4}\cdot100\%=63,89\%\)
\(\%m_K=100\%-63,89\%=36,11\%\)
Khi cô cạn dung dịch thu được muối: \(\left\{{}\begin{matrix}n_{Na^+}=0,15mol\\n_{K^+}=0,05mol\\n_{SO_4^{2-}}=n_{H_2SO_4}=n_{H_2}=0,1mol\end{matrix}\right.\)
\(\Rightarrow m_{m'}=0,15\cdot23+0,05\cdot39+0,1\cdot\left(32+4\cdot16\right)=15g\)

a) Gọi công thức chung của 2 kim loại là R
PTHH: \(R+H_2O\rightarrow ROH+\dfrac{1}{2}H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(\Rightarrow n_R=0,1\left(mol\right)\) \(\Rightarrow\overline{M}_R=\dfrac{3,26}{0,1}=32,6\)
Ta thấy \(23< 32,6< 39\) \(\Rightarrow\) 2 kim loại cần tìm là Natri và Kali
b) PTHH: \(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\uparrow\)
a_____________a______\(\dfrac{1}{2}\)a (mol)
\(K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\uparrow\)
b____________b______\(\dfrac{1}{2}\)b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}23a+39b=3,26\\\dfrac{1}{2}a+\dfrac{1}{2}b=0,05\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,04\\b=0,06\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Na}=\dfrac{0,04\cdot23}{3,26}\cdot100\%\approx28,22\%\\\%m_K=71,78\%\end{matrix}\right.\)
c) PT ion: \(OH^-+H^+\rightarrow H_2O\)
0,1____0,1
Ta có: \(n_{H^+}=n_{HCl}=0,1\left(mol\right)\) \(\Rightarrow m_{ddHCl}=\dfrac{0,1\cdot36,5}{5\%}=73\left(g\right)\)

Bài 31:
Gọi CT chung của 2 kim loại nhóm IIA (kim loại X,Y) cần tìm là Z. (M(X)<M(Z)<M(Y))
Ta có: Z +2 HCl -> ZnCl2 + H2
nH2=0,672/22,4=0,03=nZ
=> 24<M(Z)=mZ/nZ= 1,67/0,03=35,667<40
=> M(Mg) < M(Z) < M(Ca)
=> X là Magie (Mg), Y là Canxi (Ca)
=> CHỌN B
Bài 33:
nH2=0,1(mol) => mH2=0,1.2=0,2(g)
Đặt CTHH chung của 2 kim loại kiềm là A.
PTHH: A + H2O -> AOH + 1/2 H2
nH2O=nH2.2=0,1.2=0,2(mol) => mH2O=3,6(g)
Theo ĐLBTKL ta có:
mA+ mH2O = mAOH + mH2
<=>mAOH=(mA+mH2O) - mH2= 6,2 + 3,6 - 0,2= 9,6(g)
=> m(rắn)=9,6(g)
=> CHỌN C