100 ml dung dịch Fe2(SO4)3 1M có thể hòa tan tối đa m gam Cu. Giá trị của m là
A. 9,6 gam.
B. 3,2 gam.
C. 6,4 gam.
D. 12,8 gam.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Cu} = 0,1\ mol\\ n_{HNO_3} = 0,6\ mol\)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
0,1........\(\dfrac{4}{15}\)..........................................................(mol)
\(n_{H^+\ dư} = 0,6 - \dfrac{4}{15} = \dfrac{1}{3}(mol)\)
Khi thêm HCl,\(n_{H^+} = \dfrac{1}{3} + 0,2.2 = \dfrac{11}{15}\)
\(3Cu + 8H^+ + 2NO_3^- \to 3Cu^{2+} + 2NO + 4H_2O\)
\(n_{H^+} < 4n_{NO_3^-} = 0,6.4\) nên NO3- dư.
Theo PTHH :
\(n_{Cu} = \dfrac{3}{8}n_{H^+} = \dfrac{3}{8}.\dfrac{11}{15} = 0,275(mol)\\ \Rightarrow m_{Cu} = 0,275.64 = 17,6(gam)\)

nFe = 0,12 mol → ne cho = 0,36 mol; nHNO3 = 0,4 mol → ne nhận = 0,3 mol
- Do ne cho > ne nhận → Fe còn dư → dung dịch X có Fe2+ và Fe3+
- Các phản ứng xảy ra là:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
0,1 ← 0,4 → 0,1
Fe (dư) + 2Fe3+ → 3Fe2+
0,02 → 0,04
Cu + 2Fe3+ (dư) → Cu2+ + 2Fe2+
0,03 ← 0,06
→ mCu = 0,03.64 = 1,92 gam → đáp án A
Coi hỗn hợp Cu và Fe cho vào HNO3
=> 8/3nFe + 8/3nCu = n HNO3 pư = 0,4
=> n Cu = 0,03 mol
=> m Cu = 1,92 gam
D/an :A

Chọn C
Ta có nFe = 0,12 mol; nHNO3 = 0,4 mol
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
0,1 ← 0,4 → 0,1
(dư 0,02)
Fe còn dư + 2Fe(NO3)3 → 3Fe(NO3)2
0,02 → 0,04
(còn dư 0,06)
Dung dịch X chứa Fe(NO3)2 và Fe(NO3)3 còn dư
Khi cho Cu và dung dịch X thì:
Cu + 2Fe(NO3)3còn dư →Cu(NO3)2 + 2Fe(NO3)2
0,03 ← 0,06
Vậy mCu tối đa = 64.0,03 = 1,92g

nFe = 0,15 mol ; nCu = 0,1 ; nAg+ = 0,7 mol
Fe + 2Ag+ → Fe2+ + 2Ag (1)
0,15→ 0,3 0,15 0,3
Cu + 2Ag+ → Cu2+ + 2Ag
0,1 → 0,2 0,2
Fe2+ + Ag+ → Fe3+ + Ag (3)
0,15 → 0,15 0,15
Từ (1) ; (2) → m = (0,3 + 0,2 + 0,15).108 = 70,2 gam → Đáp án A

Đáp án B
Sơ đồ phản ứng
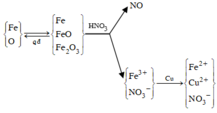
Xét toàn bộ quá trình phản ứng, ta thấy : Chất khử là Fe, Cu; chất oxi hóa là O và N + 5 trong HNO3. Theo bảo toàn electron, bảo toàn điện tích trong dung dịch sau phản ứng và giả thiết, ta có
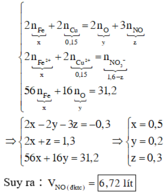
Chọn C