Khối lượng quặng photphorit chứa 65% Ca3(PO4)2 cần lấy để điều chế 150 kg photpho là (có 3% P hao hụt trong quá trình sản xuất).
A. 1,189 tấn
B. 0,2 tấn
C. 0,5 tấn
D. 2,27 tấn
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Hướng dẫn giải:
Ta có sơ đồ: Ca3(PO4)2 → 2P
Ta có: nCa3(PO4)2= 0,5.nP= 0,5.150/31= 75/31 (kmol) → mCa3(PO4)2= (75/31).310= 750 (kg)
→ Khối lượng Ca3(PO4)2 thực tế cần có: 750.100/97=773,2 kg
→Khối lượng quặng photphoric cần lấy là: 773,2.100/65= 1189 kg= 1,189 tấn

Khối lượng Fe có trong gang là mFe = 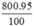 = 760 (tấn)
= 760 (tấn)
Khối lượng sắt thực tế cần để sản xuất gang (bị hao hụt 1%)
mFe = 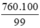 = 767,68 (tấn)
= 767,68 (tấn)
Fe3O4 + 4C → 4CO + 3Fe
232 3.56
x = ? 767,68 (tấn)
Khối lượng Fe3O4 là mFe3O4 = 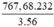 = 1060,13 (tấn)
= 1060,13 (tấn)
Khối lượng quặng manhetit là m = 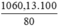 = 1325,163 (tấn)
= 1325,163 (tấn)

\(m_{Ca_3\left(PO_4\right)_2}=5.35\%=1,75\left(tấn\right)\)
Trong 1 mol Ca3(PO4)2 có 1 mol P2O5
=> Trong 310 tấn Ca3(PO4)2 tương ứng có 142 tấn P2O5
=> Trong 1,75 tấn Ca3(PO4)2 tương ứng có x tấn P2O5
=> x=\(\dfrac{1,75.142}{310}=0,8\left(tấn\right)\)
=> Chọn B

Khối lượng sắt có trong tấn gang chứa 95% sắt là : (tấn).
Khối lượng sắt thực tế cần phải có là : (tấn).
Fe3O4 -> 3Fe
232 tấn 3.56= 168 tấn
Muốn có 767,68 tấn sắt, cần : (tấn)Fe3O4
Khối lượng quặng manhetit cần dùng là : (tấn).
Đáp án A