Hấp thụ toàn bộ x mol CO2 vào dung dịch chứa 0,03 mol Ca(OH)2 được 2 gam kết tủa . Gia trị của x là
A. 0,02 mol ; 0,04 mol
B. 0,02 mol ; 0,05 mol
C. 0,01 mol ; 0,03 mol
D. 0,03 mol ; 0,04 mol
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn D
nCO2 dùng ở 2 thí nghiệm là như nhau nhưng TN2 cho nhiều BaCO3 hơn TN1
Þ Trong dung dịch sau phản ứng của TN1 còn Ba2+ cùng với CO32− hoặc HCO3-
Þ Dung dịch sau phản ứng của TN1 chỉ có Ba(HCO3)2.
Vậy ở TN1 bản chất là giống thí nghiệm 1 tạo ra 0,1 mol BaCO3 và dung dịch có a – 0,1 mol Ba(HCO3)2
Lượng NaOH thêm vào là a > nBa(HCO3)2 Þ Toàn bộ Ba2+ đã kết tủa
Þ a – 0,1 = 0,1 Þ a = 0,2; BTNT.C Þ nCO2 = 0,1 + 0,1.2 = 0,3 Þ V = 6,72.

Đáp án D
(C6H10O5)n → nC6H12O6 → 2nC2H5OH +2nCO2 ( %H = 75%)
Vì lượng NaOH cần dùng ít nhất để thu được kết tủa lớn nhất => phản ứng xảy ra theo tỉ lệ mol NaOH : Ba(HCO3) = 1 : 1
Ba(HCO3)2 + NaOH → BaCO3↓ + NaHCO3 + H2O
0,006 (mol)←0,006 (mol)
BTNT Ba => nBaCO3 (1) = nBa(OH)2 – nBa(HCO3) = 0,03 – 0,006=0,024 (mol)
BTNT C => nCO2 = nBaCO3(1) + 2nBa(HCO3) = 0,024 + 2.0,006 = 0,036 (mol)
Từ sơ đồ => ntb = ½ nCO2 = 0,018 (mol)
=> mtb lí thuyết = 0,018.162=2,916 (g)
Vì H = 75% => mtb thực tế cần lấy = mtb lí thuyết : 0,75 = 3,888(g)

Chọn D
(C6H10O5)n → nC6H12O6 → 2nC2H5OH +2nCO2 ( %H = 75%)
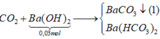
![]()
Vì lượng NaOH cần dùng ít nhất để thu được kết tủa lớn nhất => phản ứng xảy ra theo tỉ lệ mol NaOH : Ba(HCO3) = 1 : 1
Ba(HCO3)2 + NaOH → BaCO3↓ + NaHCO3 + H2O
0,006 (mol)←0,006 (mol)
BTNT Ba => nBaCO3 (1) = nBa(OH)2 – nBa(HCO3) = 0,03 – 0,006=0,024 (mol)
BTNT C => nCO2 = nBaCO3(1) + 2nBa(HCO3) = 0,024 + 2.0,006 = 0,036 (mol)
Từ sơ đồ => ntb = ½ nCO2 = 0,018 (mol)
=> mtb lí thuyết = 0,018.162=2,916 (g)
Vì H = 75% => mtb thực tế cần lấy = mtb lí thuyết : 0,75 = 3,888(g)

Đáp án D
(C6H10O5)n → nC6H12O6 → 2nC2H5OH +2nCO2 ( %H = 75%)

Vì lượng NaOH cần dùng ít nhất để thu được kết tủa lớn nhất => phản ứng xảy ra theo tỉ lệ mol NaOH : Ba(HCO3) = 1 : 1
Ba(HCO3)2 + NaOH → BaCO3↓ + NaHCO3 + H2O
0,006 (mol)←0,006 (mol)
BTNT Ba => nBaCO3 (1) = nBa(OH)2 – nBa(HCO3) = 0,03 – 0,006=0,024 (mol)
BTNT C => nCO2 = nBaCO3(1) + 2nBa(HCO3) = 0,024 + 2.0,006 = 0,036 (mol)
Từ sơ đồ => ntb = ½ nCO2 = 0,018 (mol)
=> mtb lí thuyết = 0,018.162=2,916 (g)
Vì H = 75% => mtb thực tế cần lấy = mtb lí thuyết : 0,75 = 3,888(g)

Đáp án A
CO2 + Ba(OH)2 → BaCO3 + H2O
0,03 ← 0,05-0,02
2CO2 + Ba(OH)2 → Ba(HCO3)2
0,04 ←0,02 ← 0,02
Ba(HCO3)2 → BaCO3 + CO2 +H2O
0,02 ← 0,02
=> nCO2 = 0,03+0,04 = 0,07 mol
=> n tinh bột bị lên men = 0,5nCO2 = 0,035 mol
=> m = 0,035.162.100/81 = 7,0 gam

Đáp án A
CO2 + Ba(OH)2 → BaCO3 + H2O
0,03 ← 0,05-0,02
2CO2 + Ba(OH)2 → Ba(HCO3)2
0,04 ←0,02 ← 0,02
Ba(HCO3)2 → BaCO3 + CO2 +H2O
0,02 ← 0,02
=> nCO2 = 0,03+0,04 = 0,07 mol
=> n tinh bột bị lên men = 0,5nCO2 = 0,035 mol
=> m = 0,035.162.100/81 = 7,0 gam

Đáp án A
CO2 + Ba(OH)2 → BaCO3 + H2O
0,03 ← 0,05-0,02
2CO2 + Ba(OH)2 → Ba(HCO3)2
0,04 ←0,02 ← 0,02
Ba(HCO3)2 → BaCO3 + CO2 +H2O
0,02 ← 0,02
=> nCO2 = 0,03+0,04 = 0,07 mol
=> n tinh bột bị lên men = 0,5nCO2 = 0,035 mol
=> m = 0,035.162.100/81 = 7,0 gam
Đáp án : A
Ta có : n CaCO3 = 2/100 = 0,02 mol ≠ n CaCO3 =0,03 mol
Xét 2 Trường hợp :
TH1 : chỉ xảy ra phản ứng tạo CaCO3
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
0,02 0,02
=> n CO2 = n CaCO3 =0,02 mol
TH2 : xảy ra 2 phản ứng tạo muối CaCO3và Ca(HCO3)2
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
0,02 0,02
2CO2 + Ca(OH)2 → Ca(HCO3)2
0,02 0,01
Theo phản ứng (1)và (2) : n CO2 p/ứ= 0,02 + 0,02 = 0,04 mol
=> Đáp án A
CÁCH khác : sử dụng phương pháp đồ thị :
Dựa vào đồ thị => n CO2 = 0,02 mol hoặc 0,04 mol