Nhỏ từ từ dung dịch Ba(OH)2 vào dung dịch hỗn hợp Al2(SO4)3 và AlCl3 thu được kết tủa có khối lượng theo số mol Ba(OH)2 như đồ thị:
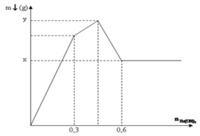
Hiệu giá trị (y – x ) bằng
A. 42,3.
B. 23,4
C. 24,3
D. 32,4.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Tại điểm 0,6 mol Ba(OH)2: Al(OH)3 tan hết
![]()
Tại điểm H kết tủa Al(OH)3 đạt cực đại nên ![]()
Tại điểm 0,3 mol Ba(OH)2 thì n S O 4 2 - hết nên n S O 4 2 - = 0,3 mol
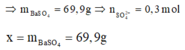
![]()
= 93,3 g
x+ y = 163,2 g

Đáp án B
Nhận thấy tại thời điểm 0,3 mol thì Ba(OH)2 kết tủa vừa đủ với Al2(SO4)3
Khi đó kết tủa gồm BaSO4 : 0,3 mol và Al(OH)3 : 0,2 mol
→ nAl2SO4 = 0,3 : 3= 0,1 mol
Tại thời điểm 0,6 mol Ba(OH)2 thì kết tủa chỉ còn BaSO4 : 0,1 mol, toàn bộ lượng Al(OH)3 bị hòa tan hết → x = 0,3. 233= 69,9 gam
→ 4∑nAl3+ = nOH- = 0,6.2 = 1,2 → ∑nAl3+ = 0,3 mol
Vậy kết tủa cực đại gồm BaSO4 : 0,3 mol và Al(OH)3 : 0,3 mol
→ y = 0,3. 233+ 0,3. 78= 93,3 gam
→ x+ y = 69,9 + 93,3 = 163,2 gam

Đáp án B
Tại điểm 0,6 mol Ba(OH)2: Al(OH)3 tan hết
![]()
Tại điểm H kết tủa Al(OH)3 đạt cực đại nên
![]()
Tại điểm 0,3 mol Ba(OH)2 thì S O 4 2 - hết nên n S O 4 2 - = 0 , 3 m o l
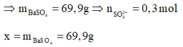
![]()
= 69,9 + 78.0,3 = 93,3 g
x+ y = 163,2 g

Đáp án B
Nhận thấy tại thời điểm 0,3 mol thì Ba(OH)2 kết tủa vừa đủ với Al2(SO4)3
Khi đó kết tủa gồm BaSO4 : 0,3 mol và Al(OH)3 : 0,2 mol
→ nAl2SO4 = 0,3 : 3= 0,1 mol
Tại thời điểm 0,6 mol Ba(OH)2 thì kết tủa chỉ còn BaSO4 : 0,1 mol, toàn bộ lượng Al(OH)3 bị hòa tan hết → x = 0,3. 233= 69,9 gam
→ 4∑nAl3+ = nOH- = 0,6.2 = 1,2 → ∑nAl3+ = 0,3 mol
Vậy kết tủa cực đại gồm BaSO4 : 0,3 mol và Al(OH)3 : 0,3 mol
→ y = 0,3. 233+ 0,3. 78= 93,3 gam
→ x+ y = 69,9 + 93,3 = 163,2 gam

Đáp án A
Ta thấy đồ thị được hình thành bởi 3 đường: (1) là kết tủa tạo thành khí Al2(SO4)3 phản ứng với Ba(OH)2 ; (2) là kết tủa tạo thành khi AlCl3 phản ứng với Ba(OH)2 ; (3) là kết tủa Al(OH)3 sinh ra bị hòa tan hết.

Đáp án B