Cho bột sắt tác dụng với dung dịch chứa 0,02 mol AgNO3 và 0,01 mol Cu(NO3)2. Phản ứng kết thúc thu được chất rắn X có khối lượng 3 gam. Trong X có:
A. Ag, Fe.
B. Ag, Cu.
C. Ag, Cu, Fe.
D. Cu, Fe.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B.
Al là kim loại hoạt động hoá học mạnh hơn Fe nên Al phản ứng hết trước. Trường hợp 1 : Al vừa đủ phản ứng, còn Fe không phản ứng và kim loại Ag, Cu được giải phóng.
Al + 3 AgNO 3 → Al NO 3 3 + 3Ag
2Al + 3 Cu NO 3 2 → 2 Al NO 3 3 + 3Cu
Trường hợp 2 : Al phản ứng hết, sau đó đến Fe phản ứng, Fe dư và kim loại Ag, Cu được giải phóng.
Fe + 2 AgNO 3 → Fe NO 3 2 + 2Ag
Fe + Cu NO 3 2 → Fe NO 3 2 + Cu
Chất rắn D gồm Ag, Cu và Fe.

Đáp án D
Có

Nếu Cu(NO3)2 phản ứng hết: m Y ⩾ m Ag + m Cu = 108 . 0 , 09 + 64 . 0 , 135 = 18 , 36 g < 22 , 84 g
=> Cu(NO3)2 đã phản ứng hết, kim loại phản ứng còn dư, muối Fe tạo thành là Fe(NO3)2 (nếu Fe đã phản ứng).
mkim loại dư = 22,84 - 18,36 = 4,48 g
Đặt số mol Fe và Mg đã phản ứng lần lượt là x, y.
ü Trường hợp 1: Fe chưa phản ứng => y = 1 2 . n NaOH = 0 , 18 mol
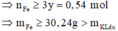
=> Loại
ü Trường hợp 2: Fe đã phản ứng → BTe n N a O H = 2 x + 2 y = 0 , 36 m o l
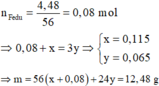

Đáp án D
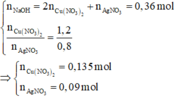
Nếu Cu(NO3)2 phản ứng hết:
m Y ⩾ m Ag + m Cu = 108 . 0 , 09 + 64 . 0 , 135 = 18 , 36 g < 22 , 84 g
=> Cu(NO3)2đã phản ứng hết, kim loại phản ứng còn dư, muối Fe tạo thành là Fe(NO3)2 (nếu Fe đã phản ứng)
m KL dư = 22 , 84 - 18 , 36 g = 4 , 48 g
Đặt số mol Fe và Mg đã phản ứng lần lượt là x, y.
ü Trường hợp 1: Fe chưa phản ứng ⇒ y = 1 2 n NaOH = 0 , 18 mol
![]()
=> Loại
ü Trường hợp 2: Fe đã phản ứng → BTe n N a O H = 2 x + 2 y = 0 , 36 m o l
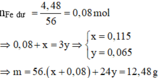

\(n_{Fe}=\dfrac{2,8}{56}=0,05mol\)
\(n_{Al}=\dfrac{0,81}{27}=0,03mol\)
\(B:8,12g\left\{{}\begin{matrix}Cu:a\left(mol\right)\\Ag:b\left(mol\right)\\Fe:c\left(mol\right)\end{matrix}\right.\Rightarrow64a+108b+56c=8,12\)(*)
\(n_{H_2}=\dfrac{0,672}{22,4}=0,03mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,03 0,03
\(\Rightarrow c=n_{Fe}=0,03mol\)
Thay vào (*) ta được: \(64a+108b=8,12-0,03\cdot56\left(1\right)\)
\(n_{Fepư}=0,05-0,03=0,02mol\)
\(BTe:2n_{Cu}+n_{Ag}=3n_{Fepư}+2n_{H_2}\)
\(\Rightarrow2a+b=2\cdot0,02+3\cdot0,03\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,05\\b=0,03\end{matrix}\right.\)
\(C_{M_{Cu\left(NO_3\right)_2}}=\dfrac{0,05}{0,1}=0,5M\)
\(C_{M_{AgNO_3}}=\dfrac{0,03}{0,1}=0,3M\)

Chọn đáp án A
![]()
⇒ E gồm 3 kim loại thì đó là Ag, Cu và Fe dư ⇒ nFe dư = nH2 = 0,03 mol
Đặt n A g + = x mol; n C u 2 + = y mol ||→ mE = 8,12 gam = 108x + 64y + 0,03 × 56
![]()
![]()
Giải hệ có: x = 0,03 mol; y = 0,05 mol
![]()

Đáp án A.
Vì phản ứng giữa Al và AgNO3 xảy ra trước nên kim loại sau phản ứng phải có Ag, kế đến là CuSO4 có phản ứng tạo thành Cu. Theo giả thiết, có ba kim loại → kim loại thứ ba là Fe còn dư.
Ta có: nFe = 2,8/5,6 = 0,05 (mol)
nAl = 0,81/27 = 0,03 (mol)
và = 0,672/22,4 = 0,03 (mol)
Phản ứng: Fedư + 2HCl → FeCl2 + H2
(mol) 0,03 0,03
→ Số mol Fe phản ứng với muối: 0,05 – 0,03 = 0,02 (mol)
2Al + 3Cu2+ → 2Al3+ + 3Cu
Fe + 2Ag+ → Fe2+ + 2Ag
Fe + Cu2+ → Fe2+ + Cu
Ta có sự trao đổi electron như sau:
Al → Al3+ + 3e Fe → Fe2+ + 2e
0,03 0,09 (mol) 0,02 0,04 (mol)
Ag+ + 1e → Ag Cu2+ + 2e → Cu
x x x (mol) y 2y y (mol)
→ x + 2y = 0,09 + 0,04 = 0,13 (1) ; 108x + 64y + 56.0,03 = 8,12 (2)
Giải hệ phương trình (1) và (2), ta được x = 0,03; y = 0,05.
Vậy:

Đáp án C
Thứ tự các phản ứng xảy ra:
Nếu chỉ xảy ra phản ứng (1), cả Fe và AgNO3 đều hết thì mx = m1 = mAg = 0,02. 108 = 2,16 (gam)
Nếu xảy ra cả phản ứng (1) và (2) với các chất đều hết thì mx = m2 = mAg + mCu = 2,8 (gam)
Có mx > m1 và mx > m2 nên X gồm Ag, Cu và Fe dư.