Thể tích dung dịch HNO3 1M (loãng) ít nhất cần dùng để hòa tan hoàn toàn một hỗn hợp gồm 0,15 mol Fe và 0,15 mol Cu là (biết phản ứng tạo chất khử duy nhất là NO)
A. 1,0 lít
B. 0,6 lít
C. 0,8 lít
D. 1,2 lít
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nFe = nCu = 0,15 mol
- Do thể tích dung dịch HNO3 cần dùng ít nhất → muối Fe2+ → ∑ ne cho = 2.(0,15 + 0,15) = 0,6 mol
- Theo đlbt mol electron nH+ = nHNO3 = (0,6.4)/3 = 0,8
→ VHNO3= 0,8 lít → đáp án C
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O
0,15..0,6.........0,15 mol
2Fe{3+} + Cu = 2Fe{2+} + Cu{2+}
0,15.........0,075 mol
=> nCu (dư) = 0,15 - 0,075 = 0,075 mol
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
nHNO3 = 8/3nCu (dư) = 8/3.0,075 = 0,2 mol
=> ƩnHNO3 = 0,6 + 0,2 = 0,8 mol
=> VHNO3 = 0,8

Đáp án C
Lượng HNO3 tối thiểu cần dùng khi: Fe → Fe2+ , Cu → Cu2+
Sơ đồ cho nhận e :
Fe – 2e → Fe2+
0,15 0,3
Cu – 2e → Cu2+
0,15 0,3
N+5 + 3e → N+2
3x x
→ Theo định luật bảo toàn mol e : 0,3 + 0,3 = 3x → x = 0,2 mol
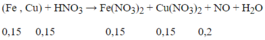
→ Bảo toàn nguyên tố N : Số mol HNO3 = 0,3 + 0,3 + 0,2 = 0,8 mol
VHNO3 = 0,8 /1 =0,8 lit
Chọn đáp án C