Phân tích 2,36 gam chất Y thu được 5,28 gam CO2; 3,24 gam H2O; còn N chuyển hóa thành NH3. Cho lượng NH3 thu được vào 20ml dung dịch H2SO4 2M. Sau đó phải dùng 100 ml dung dịch NaOH 0,4M để trung hòa H2SO4 còn dư. Tỷ khối hơi của Y so với khí H2 là 29,5. Công thức phân tử của Y là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

CO2 : \(n_{CO_2}=\dfrac{5.28}{44}=0.12\left(mol\right)\)
\(\%C=\dfrac{0.2\cdot12}{5.28}\cdot100\%=45.45\%\)
\(\%H=100\%-45.45\%=54.55\%\)
H2O : \(n_{H_2O}=\dfrac{3.24}{18}=0.18\left(mol\right)\)
\(\%H=\dfrac{0.18\cdot2}{3.24}\cdot100\%=11.11\%\)
\(\%O=100\%-11.11\%=88.89\%\)
SO2 : \(n_{SO_2}=\dfrac{3.54}{64}=\dfrac{177}{3200}\left(mol\right)\)
\(\%S=\dfrac{\dfrac{177}{3200}\cdot32}{3.54}\cdot100\%=50\%\)
\(\%O=100\%-50\%=50\%\)

Đáp án D
Đặt số mol este và nước lần lượt là x, y
+ Khi đốt cháy este: n este=nCO2-nH2O=>x=0,48-y (1)
+ BTNT O: 2neste+2nO2=2nCO2+nH2O => 2x+0,54.2=0,48.2+y (2)
=>x=0,12 mol; y=0,36mol
nY=neste=0,12mol=>MY=5,28/0,12=44 (CH3CHO)
+BTKL:
meste=mCO2+mH2O-mO2
=0,48.44+0,36.18-0,54.32=10,32 gam
=>MX=10,32/0,12=86 (CH3COOCH=CH2)
m muối=mCH3COOK=0,12.98=11,76 gam

Chọn đáp án B
để ý: n CO2 - n H2O = 0,05 mol = 5.n X. → trong X có 6 liên kết pi.
► Tuy nhiên, thật để ý rằng: trong 3 liên kết este -COOR đã có 3 liên kết pi → X còn 3 pi trong hđc.
Vậy: X + 3H2 → X'. có số mol H2 = 0,45 mol → n X = 0,15 mol và a = 133,5 - 0,45 × 2 = 132,6 gam.
Thủy phân: X + 3KOH → muối + glixerol.
KOH chỉ phản ứng 0,45 mol, còn dư 0,05 mol. → n glixerol = 0,15 mol.
Bảo toàn khối lượng: m rắn = 132,6 + 0,5 × 56 - 0,15 × 92 = 146,8 gam.

Theo đề bài ta có 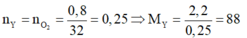
Vì sản phẩm cháy thu được CO2 và H2O nên Y chắc chắn chứa C, H, có thể có O.
Khối lượng các nguyên tố trong 4,4 gam chất Y là:
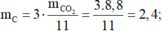
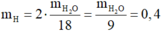
![]()
Gọi CTPT của chất Y là CxHyOz . ta có như sau:
Vậy ta có x = 4, y = 8 và z = 2
CTPT của Y là C4H8O2
Đáp án A.

Đáp án B
nC = nCO2 = 0,12 mol
nH = 2nH2O = 0,12 mol
mO = mX – mC – mH = 2,04 – 12.0,12 – 1.0,12 = 0,48 gam => nO = 0,03 mol
=> C:H:O = 0,12:0,12:0,03 = C4H4O. Do este đơn chức nên chứa 2O => CTPT: C8H8O2

Đáp án D
Este đơn chức → CxHyO2
Phản ứng:
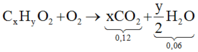
Bảo toàn nguyên tố
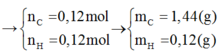
![]()
![]()
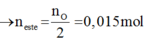
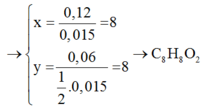

Đáp án B
nC = nCO2 = 0,12 mol
nH = 2nH2O = 0,12 mol
mO = mX – mC – mH = 2,04 – 12.0,12 – 1.0,12 = 0,48 gam => nO = 0,03 mol
=> C:H:O = 0,12:0,12:0,03 = C4H4O. Do este đơn chức nên chứa 2O => CTPT: C8H8O2

Đáp án D
Este đơn chức → CxHyO2
Phản ứng:
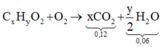
Bảo toàn nguyên tố

![]()
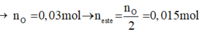
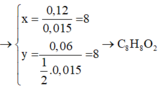

Chọn B
nC = nCO2 = 0,12 mol
nH = 2nH2O = 0,12 mol
mO = mX – mC – mH = 2,04 – 12.0,12 – 1.0,12 = 0,48 gam => nO = 0,03 mol
=> C:H:O = 0,12:0,12:0,03 = C4H4O. Do este đơn chức nên chứa 2O => CTPT: C8H8O2
Đáp án A
Quan sát 4 đáp án ta có công thức của Y có dạng CxHyNt.
Căn cứ vào 4 đáp án ta được Y là C3H9N.
Nhận xét: Vì đây là dạng câu hỏi trắc nghiệm có 4 đáp án nên từ đặc điểm của 4 đáp án ta suy ra được Y không có chứa O. Khi đó tính được ngay khối lượng N trong Y khi biết khối lượng của Y và khối lượng của C, H trong Y. Với bài tập tự luận từ các sản phẩm cháy ta chỉ suy ra được Y chứa C, H, N và có thể có O. Khi đó các bạn cần dựa vào giả thiết về NH3 phản ứng với dung dịch H2SO4 để tính được lượng NH3. Tiếp theo mới tính được xem Y có chứa O hay không. Cụ thể như sau:
Vì H2SO4 dư nên có phản ứng: