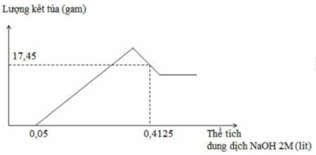
Hòa tan hoàn toàn m gam hỗn hợp Al và Mg trong V ml dung dịch HNO3 2,5 M. Kết thúc phản ứng thu được dung dịch X ( không chứa muối amoni) và 0,084 mol hỗn hợp khí gồm N2 và N2O có tỉ khối so với oxi là 31:24. Cho từ từ dung dịch NaOH 2M vào dung dịch X thì lượng kết tủa biến thiên theo đồ thị hình vẽ dưới đây:
Giá trị của m và V lần lượt là
A. 6,36 và 378,2.
B. 7,8 và 950.
C. 8,85 và 250.
D. 7,5 và 387,2.

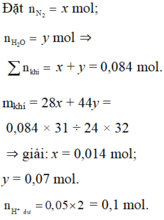
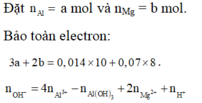
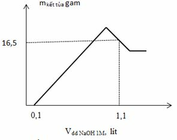
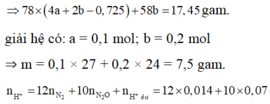 + 0,1 = 0,968 mol
+ 0,1 = 0,968 mol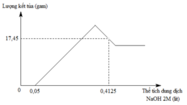
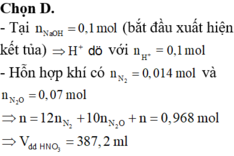

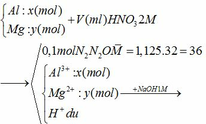
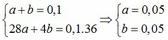


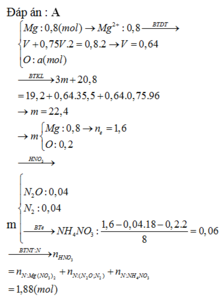
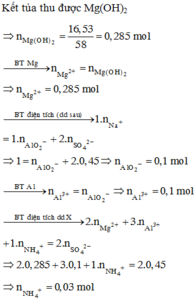
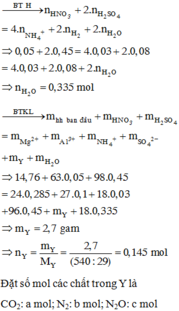

Giải thích:
Theo quy tắc đường chéo tính được N2 :0,014 mol và N2O : 0,07 mol
Đặt nAl = x mol nMg= y mol
Dd X có dư HNO3 nên Al và Mg phản ứng hết
Al → Al+3 + 3e Mg → Mg+2 + 2e
2N+5 + 10e → N2 2N+5 + 8e → 2N+1
Bảo toàn e thì 3x + 2y = 0,014.10 +0,07.8=0,7
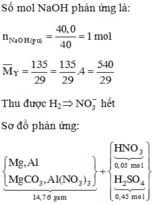
Cho NaOH vào NaOH + HNO3 → NaNO3 + H2O → HNO3 dư :0,1 mol
Tại thể tích NaOH là 0,4125 lít thì kết tủa qua vị trí cực đại → Al(OH)3 bị hòa tan một phần
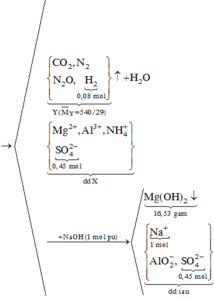
2OH- + Mg2+ → Mg(OH)2
3OH- + Al3+ → Al(OH)3
Al(OH)3 + OH- → AlO2- +H2O
Kết tủa có Mg(OH)2 : y mol, Al(OH)3 : x-z mol( giả sử z mol Al(OH)3 bị hòa tan)
Ta có
17,45=58y+78(x-z)=m↓
2y + 3x + z =(0,4125-0,05).2=nNaOH
→ x= 0,1 mol ; y=0,2 mol; z=0,025 mol
→ m= 27x + 24y=7,5
Bảo toàn N trong phản ứng X + HNO3 có
nHNO3 = 3x + 2y + 2nN2 + 2nN2O + nHNO3 dư = 0,968 → V=0,3872
Đáp án D