Cho 5 gam Mg vào 100 ml dung dịch A g N O 3 2M. Sau khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
A. 15,8
B. 21,6
C. 24,2
D. 21,8
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

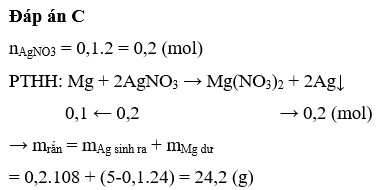

đây ạ
nFe = 8.4/56=0.15 mol
nCu = 6.4/64=0.1 mol
nAgNO3 = 0.35*2=0.7 mol
Fe + 2AgNO3 --> Fe(NO3)2 + 2Ag
0.15___0.3________0.15_____0.3
Cu + 2AgNO3 --> Cu(NO3)2 + 2Ag
0.1____0.2________0.1_______0.2
nAgNO3( còn lại ) = 0.7 - 0.3 - 0.2 = 0.2 mol
Vì : AgNO3 còn dư nên tiếp tục phản ứng với Fe(NO3)2
Fe(NO3)2 + AgNO3 --> Fe(NO3)3 + Ag
Bđ: 0.15________0.2
Pư: 0.15________0.15_______________0.15
Kt: 0___________0.05_______________0.15
Chất rắn : 0.65 (mol) Ag
mAg = 0.65*108 = 70.2g

Đáp án C
Ta có: ![]()
Ta có: ![]()
Bảo toàn điện tích:

Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL:
Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL: ![]()
![]()

Đáp án D
nAgNO3 = 0,036 mol
nCu(NO3)2 = 0,024 mol
Xét cả quá trình phản ứng, ta thấy chỉ có Mg nhường e và Ag+, Cu2+ nhận e.
Bte: 2nMg pư = nAg+ + 2nCu2+ => nMg pư = (0,036 + 2.0,024):2 = 0,042 mol
=> nMg dư = 0,08 – 0,042 = 0,038 mol
Ta có: mX + mY = m + mAg + mCu + mMg dư => 4,21 + 4,826 = m + 0,036.108 + 0,024.64 + 0,038.24
=> m = 2,7 gam

Đáp án C
Ta có: ![]()
Ta có: ![]()
Bảo toàn điện tích:
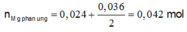
Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL: m = 4,826 - 0,038.24 + 4,21 - 0,036.108 - 0,024.64 = 2,7 gam