Cho 2,236 gam hỗn hợp A dạng bột gồm Fe và Fe3O4 hòa tan hoàn toàn trong 100ml dung dịch HNO3 có nồng độ C (mol/l), có 246,4 ml khí NO (dktc) thoát ra. Sau phản ứng còn lại 0,448 gam kim loại. Trị số của C là:
A. 0,5M
B. 0,68M
C. 0,4M
D. 0,72M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Định hướng tư duy giải
Tư duy đi tắt đòn đầu
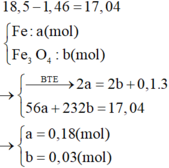
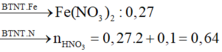
=> [HNO3] = 3,2 (M)

Quy hỗn hợp X thành Fe phản ứng (a mol) và O (b mol) và 1,46 g Fe không tan
Bảo toàn khối lượng => 56a + 16b + 1,46 = 18,5

Đáp án B

Chọn đáp án A
Quy đổi A về Fe và O, vì có kim loại chưa tan nên xem như Fe chỉ lên Fe+2
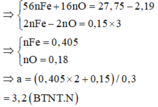
Sau phản ứng còn kim loại => Sản phẩm là Fe2+
=>Giả sử có x mol Fe và y mol O phản ứng
=> 56x + 16y = 2,236 – 0,448 = 1,788g
Các quá trình: +/ Cho e: Fe → Fe+2 + 2e
+/ Nhận e : O + 2e → O-2
N+5 +3e → N+2
=> n e trao đổi = 2x = 2y + 0,011.3
=>x= 0,0285 mol ; y= 0,012 mol
=> số mol HNO3 = 2nFe2+ + n NO = 0,068 mol (Bảo toàn N)
=> C = 0,68M
=>B