Cho 6,88 gam hỗn hợp chứa Mg và Cu với tỷ lệ mol tương ứng là 1 :4 vào dung dịch chứa 0,12 mol Fe(NO3)3. Sau khi các phản ứng hoàn toàn thu được m gam kim loại. Giá trị của m là:
A. 5,12
B. 3,84
C. 2,56
D. 6,96
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
- Hướng tư duy 1: Cân bằng phương trình
Mg + 2Fe3+ → Mg2+ + 2Fe2+
mol: 0,02 → 0,04 0,04 => n Fe3+còn lại = 0,08 mol
Cu + 2Fe3+ → Cu2+ + 2Fe2+
mol: 0,04 ← 0,08 => nCu dư = 0,06 mol
Vậy mrắn = mCu dư = 3,84 (g)

Đáp án B
Hướng dẫn tư duy 1: Cân bằng phương trình
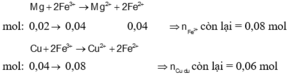
![]()
Hướng dẫn tư duy 2: Sử dụng bảo toàn e
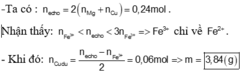

Đáp án : D
nMg = 0,1 ; nFe = 0,19 mol
Thứ tự phản ứng :
Mg + 2Ag+ -> Mg2+ + 2Ag
Fe + 2Ag+ -> Fe2+ + 2Ag
Fe + Cu2+ -> Fe + Cu
=> Kết tủa gồm : Ag : 0,3 mol ; Cu : 0,14 mol
=> m = 41,36g

Đáp án B
Đặt nZn = x mol ; nCu =2x mol
=> m hỗn hợp = 65x +64.2x =19,3 g => x = 0,1 mol
Có nFe3+ = 0,4 mol ,Xảy ra các quá trình sau:
Zn + 2Fe3+ → Zn 2+ + 2Fe2+
Mol 0,1 -> 0,2
Cu +2 Fe3+ → Cu 2+ + 2Fe2+ Mol 0,1 <- 0,2
=> m = mCu dư = 0,1 .64 = 6,4g
Đáp án B.
Định hướng tư duy giải