Oxi hoá 89,6 lít SO2(đktc) có xt thu được 240 gam SO3.Tính hiệu suất?
A.50%
B.75%
C.80%
D.Kết quả khác
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a. \(2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO_4}=0,6mol\)
\(\rightarrow n_{O_2}=\frac{1}{2}n_{KMnO_4}=0,3mol\)
\(\rightarrow V_{O_2}=6,72l\)
\(V_{O_2\text{thực}}=\frac{6,72.75}{100}=5,04l\)
b. \(2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
\(n_{O_2}=1,5mol\)
\(\rightarrow n_{KMnO_4}=2n_{O_2}=3mol\)
\(\rightarrow m_{KMnO_4\text{cần}}=\frac{474.100}{80}=592,5g\)

Đáp án C.
Khối lượng mol phân tử của X : 1,0625 x 32 = 34 (gam).
n SO 2 = 2,24/22,4 = 0,1 mol.
Trong 0,1 mol SO 2 có 0,1 mol nguyên tử s ứng với khối lượng : m S = 32 x 0,1 = 3,2 (gam).
n H 2 O = 1,8/18 = 0,1 mol trong đó có 0,2 mol nguyên tử H ứng với khối lượng : 1 x 0,2 = 0,2 (gam).
m X = m S + m H = 3,4g như vậy chất X không có oxi.
n X = 3,4/34 = 0,1 mol
Do đó : 0,1 mol phân tử X có chứa 0,1 moi nguyên tử S và 0,2 mol nguyên tử H.
Vậy 1 mol phân tử X có chứa 1 mol nguyên tử S và 2 mol nguyên tử H
Công thức hoá học của hợp chất X là H 2 S

PTHH: \(4FeS+7O_2\rightarrow^{t^o}2Fe_2O_3+4SO_2\uparrow\)
\(2SO_2+O_2\rightarrow^{t^o}2SO_3\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(n_{H_2SO_4}=\frac{50.12,25\%}{98}=0,0625mol\)
Theo phương trình \(n_{SO_3}=n_{SO_2}=n_{H_2SO_4}=0,0625mol\)
\(\rightarrow m_{SO_2}=0,0625.64=4g\)
\(\rightarrow m_{SO_3}=0,0625.80=5g\)
Theo phương trình \(n_{FeS}=n_{SO_2}=0,0625mol\)
\(\rightarrow m_{FeS}=0,0625.88=5,5g\)

a. PTHH: \(KMnO_4\rightarrow^{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
b. \(H=100\%\)
\(n_{KMnO_4}=\frac{3,6}{158}=0,023mol\)
Theo phương trình \(n_{O_2}=0,5n_{KMnO_4}=0,046mol\)
\(\rightarrow V_{O_2}=0,0115.22,4.100\%=0,2576l\)
c. H = 80%
\(\rightarrow V_{O_2}=0,0115.22,4.80\%=0,20608l\)

Đáp án A
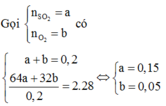
Có: ![]()
Mol trước phản ứng 0,15 0,05
Mol phản ứng 2x x 2x
Mol cân bằng (0,15 – 2x) (0,05 – x) 2x
Do đó
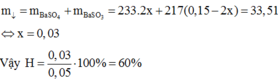

Đáp án A
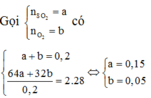
Có: ![]()
Mol trước phản ứng 0,15 0,05
Mol phản ứng 2x x 2x
Mol cân bằng (0,15 – 2x) (0,05 – x) 2x
Do đó
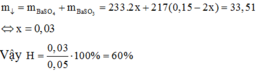

\(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,3<---------------------------0,15
=> mKMnO4(pư) = 0,3.158 = 47,4 (g)
\(H\%=\dfrac{m_{KMnO_4\left(pư\right)}}{m_{KMnO_4\left(bđ\right)}}.100\%=\dfrac{47,4}{63,2}.100\%=75\%\)
=> C

Đáp án : D
MX = 56g ; nX = 0,2 mol
=> nSO2 = 0,15 ; nO2 = 0,05 mol
SO2 + ½ O2 -> SO3
.x -> 0,5x -> x
=> sau phản ứng có (0,15 – x) mol SO2 và x mol SO3 phản ứng với Ba(OH)2
=> kết tủa gồm : (0,15 – x) mol BaSO3 và x mol BaSO4
=> 217(0,15 – x) + 233x = 33,19g
=> x = 0,04 mol
=> H% O2 = 40% ( tính theo chất nào có hiệu suất tính được cao hơn)
Đáp án B