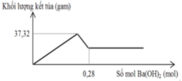
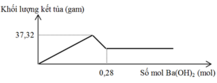
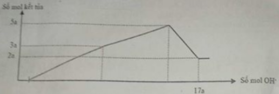
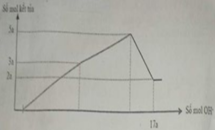
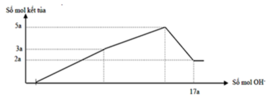
Cho m gam hỗn hợp gồm Na2O và Al2O3 vào 400 ml dung dịch H2SO4 0,3M và HCl 0,9M. Sau khi kết thúc phản ứng, thu được dung dịch X. Cho dung dịch Ba(OH)2 dư vào X, phản ứng được biểu diễn theo đồ thị sau:

Giá trị của m là
A. 16,04 gam
B. 17,20 gam
C. 11,08 gam
D. 9,84 gam.





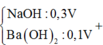





Đáp án C
Cho hỗn hợp Na2O và Al2O3 vào 0,12 mol H2SO4 và 0,36 mol HCl thu được dung dịch X.
Cho Ba(OH)2 dư vào X ta thấy đồ thị như trên do vậy có các giai đoạn:
+Giai đoạn kết tủa tăng do tạo kết tủa BaSO4 và Al(OH)3.
+Kết tủa giảm do có sự hòa tan Al(OH)3.
+Kết tủa không đổi lúc này chỉ còn BaSO4.
Có n(H2SO4) = 0,12 (mol) và n(HCl) = 0,36 (mol)
→ n(BaSO4 max) = 0,12 mol và n(Al(OH)3 max) = 0,12 (mol)
Do kết tủa vẫn còn Al(OH)3 nên X phải có Al3+ → Dung dịch X không có OH- và AlO2-.
→ X có chứa Al3+ (0,12 mol); Na+ (a mol); H+ (b mol); Cl- (0,36 mol); SO42- (0,12 mol)
BT điện tích cho X: a + b = 0,12. 3 = 0,36 + 0,12. 2 (1)
Khi n(Ba(OH)2) = 0,28 mol hay n(OH-) = 0,56 mol thì Al(OH)3đã bị hòa tan hoàn toàn nên:
0,56 – b = 0,12. 4 → b = 0,08 → a = 0,16 mol
Vậy ban đầu n(Na2O) = a/2 = 0,08 mol và n(Al2O3) = 0,12 : 2 = 0,06 mol
→ m = 11,08 (g)