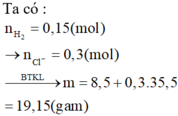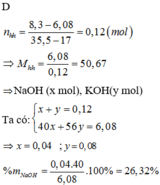Cho 6,08 gam hỗn hợp X gồm 2 hiđroxit của 2 kim loại kiềm tác dụng hết với dung dịch HCl dư thấy tạo ra 8,30 gam hỗn hợp muối clorua. Biết 2 kim loại kiềm thuộc 2 chu kì liên tiếp trong BTH, tính % số mol mỗi hiđroxit trong hỗn hợp ban đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.




Đáp án : C
Tổng quát :
M + Cl -> MCl
M + ½ SO4 -> ½ M2SO4
=> mmuối sunfat - mmuối clorua = mSO4 – mCl = 96.0,5x – 35,5x = 12,5x
=> x = (b – a)/12,5

Đáp án C
Hướng dẫn Ta có: ![]()
![]() Cl + AgNO3 →
Cl + AgNO3 → ![]() NO3 + AgCl
NO3 + AgCl
0,13 mol 0,13 mol
=> (![]() + 35,5).0,13 = 6,645 →
+ 35,5).0,13 = 6,645 → ![]() = 15,62
= 15,62
Mà 2 kim loại kiềm thuộc hai chu kì kế tiếp nhau → Li (7) và Na(23)

Đặt tên chung của 2 kim loại A,B đó là Z \(\left(M_A< M_Z< M_B\right)\)
\(2M+2HCl\rightarrow2MCl+H_2\\ n_{HCl}=n_M=n_{Cl^-}=\dfrac{18,65-8}{35,5}=0,3\left(mol\right)\\ \Rightarrow M_Z=\dfrac{8}{0,3}\approx26,667\left(\dfrac{g}{mol}\right)\\ \Rightarrow\left\{{}\begin{matrix}A:Natri\left(Na=23\right)\\B:Kali\left(K=39\right)\end{matrix}\right.\)

MCl + AgNO3 -> AgCl + MNO3 (M là hai kim loại kiềm)
mol: 0,13 0,13
Ta có : (M+35,5).0,13 = 6,645
=> M = 15,62
Hai kim loại kiềm trên là Li và Na.
=> Đáp án D

Coi hỗn hợp hai kim loại là R
2R + 2H2O → 2ROH + H2
$n_{HCl} = 0,1.0,8 = 0,08(mol) ; n_{NaOH} = \dfrac{0,8}{40} = 0,02(mol)$
NaOH + HCl → NaCl + H2O
0,02.........0,02...0,02......................(mol)
ROH + HCl → RCl + H2O
0,06....0,06......0,06...................(mol)
Suy ra: $0,02.58,5 + 0,06(R + 35,5) = 5,4 \Rightarrow R = 35$
Vậy hai kim loại là Natri(x mol) và Kali(y mol)
Ta có :
$x + y = 0,06$
$R = \dfrac{23x + 39y}{x + y} = \dfrac{23x + 39y}{0,06} = 35$
Suy ra x = 0,015 ; y = 0,045
$m_{Na} = 0,015.23 = 0,345(gam)$
$m_{Kali} = 0,045.39 = 1,755(gam)$