Hòa tan hoàn toàn hỗn hợp gồm 13 gam kẽm và 5,6 gam sắt trong dung dịch H2SO4 loãng dư thì khối lượng dung dịch sau phản ứng thay đổi như thế nào?
A. tăng 18,6 gam.
B. giảm 0,6 gam.
C. tăng 18 gam.
D. giảm 18,6 gam.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C
H2SO4 loãng dư Þ nZn + nFe = 0,3 = nH2 (phản ứng hoàn toàn)
Þ Dm = 13 + 5,6 — 0,3.2 = +18 Þ Tăng 18 gam

Đáp án B
m k l d d tan g = m ( g ) = m h h b a n d a u ⇒ không có sản phẩm khử khí.
![]()
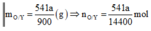
![]()
⇒ ∑ n N O 3 = 9 n N H 4 N O 3 = n O / 3
![]()
![]()
![]()
![]()
![]()
![]()
Tăng giảm khối lượng
![]()
⇒ a = 64 , 68 ( g )

Chọn B.
Nhận xét: Hòa tan hết m gam…,kết thúc thu được…tăng cũng m gam nên phản ứng giữa các kim loại với HNO3 chỉ thu được sản phẩm khử duy nhất là muối NH4NO3 (không có khí thoát ra)
Sơ đồ phản ứng:
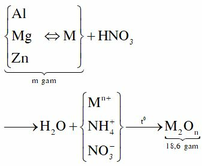
Ta có: Tổng số mol electron cho
của kim loại = tổng số mol điện tích
của các kim loại (M → Mn+ + ne)
Nên gọi số mol NH4NO3 là x mol thì

Vậy m = 12,84gam và a = 18,6 + 512x = 64,68gam

\(n_{HCHO}=\dfrac{0,6}{30}=0,02\left(mol\right)\\ n_{C_2H_5CHO}=\dfrac{1,74}{58}=0,03\left(mol\right)\)
PTHH:
\(HCHO+O_2\xrightarrow[]{t^o}CO_2+H_2O\)
0,02-------------->0,02--->0,02
\(C_2H_5CHO+4O_2\xrightarrow[]{t^o}3CO_2+3H_2O\)
0,03--------------------->0,09---->0,09
\(\rightarrow\left\{{}\begin{matrix}n_{CO_2}=0,02+0,09=0,11\left(mol\right)\\n_{H_2O}=0,02+0,09=0,11\left(mol\right)\end{matrix}\right.\)
Vì \(Ba\left(OH\right)_2\) dư \(\rightarrow\) chỉ tạo muối \(BaCO_3\)
PTHH: \(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3\downarrow+H_2O\)
0,11---->0,11
\(m_{giảm}=m_{BaCO_3}-m_{CO_2}-m_{H_2O}=0,11.197-0,11.44-0,11.18=14,85\left(g\right)\)
\(\rightarrow B\)
Đáp án C