Hòa tan hết m gam S O 3 vào nước thu được 98 gam dung dịch axit sunfuric có nồng độ 12,5%. Khối lượng m gam S O 3 là:
A. 20g
B. 15g
C. 25g
D. 10g
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong dd 10%: mNaOH = 0,1.m1
Trong dd 40%: mNaOH = 0,4.m2
Trong 60 gam dd 20%: mNaOH = 12 gam
Có hệ: m dd = m1 + m2 = 60 gam
m NaOH = 0,1m1 + 0,4m2 = 12 gam
➝ m1 = 40 gam, m2 = 20 gam

\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
0,305 0,305 0,305 0,305
\(n_{H_2}=\dfrac{6,832}{22,4}=0,305\left(mol\right)\)
\(a,m_{H_2SO_4}=98.0,305=29,89\left(g\right)\)
\(m_{ddH_2SO_4}=\dfrac{28,89}{12,5}.100\approx199,3\left(g\right)\)
\(m_{Mg}=24.0,305=7,32\left(g\right)\)
\(m_{H_2}=0,305.2=0,61\left(g\right)\)
Áp dụng định luật bảo toàn khổi lượng , ta có :
\(m_{MgSO_4}=\left(199,3+7,32\right)-0,61=206,01\left(g\right)\)
\(b,m_{MgSO_4}=0,305.120=36,6\left(g\right)\)
\(C\%_{MgSO_4}=\dfrac{36,6}{206,01}.100\%\approx17,8\%\)


BTKL: mD + mNaHCO3 = mCO2 + mE
mD + 179,88 = 44.0,2 + 492 => mD = 320,92
BTKL: mMg + mddHCl = mH2 + mD
=> 24 . 0,4 + mddHCl = 2 . 0,4 + 320,92 => mddHCl = 312,12
=> C%HCl = 11,69%

\(n_{Na}=\dfrac{3,45}{23}=0,15\left(mol\right)\)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
0,15 0,15 0,15 0,075
a. \(m_{H_2O}=0,15.18=2,7\left(g\right)\)
b. \(n_{O_2}=\dfrac{1,6}{32}=0,05\left(mol\right)\)
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
0,075 0,075
Lập tỉ lệ: \(\dfrac{0,075}{2}< \dfrac{0,05}{1}\)
=> Lượng \(H_2\) sinh ra không đủ để pứ với 1,6 g \(O_2\)
\(m_{H_2O}=0,075.18=1,35\left(g\right)\)
a) \(n_{Na}=\dfrac{3,45}{23}=0,15\left(mol\right)\)
PTHH: 2Na + 2H2O ---> 2NaOH + H2
0,15---------------->0,15---->0,075
=> \(m_{\text{dd}NaOH}=\dfrac{0,15.40}{10\%}=60\left(g\right)\)
Ta có: \(m_{\text{dd}NaOH}=m_{Na}+m_{H_2O}-m_{H_2}\)
=> \(m=m_{H_2O}=60-3,45+0,075.2=56,7\left(g\right)\)
b) \(n_{O_2}=\dfrac{1,6}{32}=0,05\left(mol\right)\)
PTHH: \(2H_2+O_2\xrightarrow[]{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,075}{2}< \dfrac{0,05}{1}\Rightarrow O_2\) dư, H2 không đủ để đốt cháy hết
Theo PTHH: \(n_{H_2O}=n_{H_2}=0,075\left(mol\right)\)
=> \(m_{s\text{ản}.ph\text{ẩm}}=m_{H_2O}=0,075.18=1,35\left(g\right)\)

a) 2Al (0,2) + 3H2SO4 (0,3) -----> Al2(SO4)3 + 3H2 (0,3)
b) - nH2 = 0,3 mol
- Theo PTHH: nAl = 0,2 mol
=> mAl = 5,4 gam
=> mCu = 4,6 gam
==>mhh=5,4+4,6=10 g
b Theo PTHH: nH2SO4 = 0,3 mol
=> mH2SO4 = 29,4 gam
=> mdd H2SO4 = 29,4.100\20=147gam
\(2Al+3H_2SO_4-->Al_2\left(SO_4\right)_3+3H_2\left(1\right)\)
0,2______0,3_____________0,1________0,3
\(n_{H_2}=\frac{6,72}{22,4}=0,3\left(mol\right)\)
a) => \(m=0,2.27+10=15,4\left(g\right)\)
b) \(m_{d^2H_2SO_4}=\frac{0,3.98.100}{20}=147\left(g\right)\)
c) \(Ba+2H_2O-->Ba\left(OH\right)_2+H_2\left(2\right)\)
0.35__________________0,35
\(n_{Ba}=\frac{47,95}{137}=0,35\left(mol\right)\)
\(3Ba\left(OH\right)_2+Al_2\left(SO_4\right)_3-->3BaSO_4\downarrow+2Al\left(OH\right)_3\downarrow\)
0,3___________0,1_______________0,3 _______0,2
\(2Al\left(OH\right)_3+Ba\left(OH\right)_2-->Ba\left(AlO_2\right)_2+4H_2O\left(3\right)\)
0,1__________0,05__________0,05
\(m_{d^2sau}=0,2.27+147-0,3.2+47,95-0,3.233-0,2.78=137,55\left(g\right)\)
\(C\%_{Ba\left(AlO_2\right)_2}=\frac{0,05.255}{137,55}.100=9,27\%\)

Đáp án C.
Số mol CO2 là: 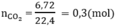
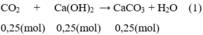
Theo pt (1): nCO2 = nCa(OH)2 = 0,25 mol
nCO2 (dư ) = 0,3 – 0,25 = 0,05 (mol)
Xảy ra phản ứng:
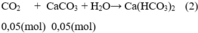
Theo pt(2): nCaCO3 pư = nCO2 = 0,05 mol
Như vậy CaCO3 không bị hòa tan là: 0,25 – 0,05 = 0,2(mol)
Khối lượng kết tủa thu được là m = 0,2. 100 = 20(g)
Chọn D