Hãy so sánh hoá trị của các kim loại trong các hợp chất :NaCl, CaF 2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Trong các hợp chất H 2 O ; NH 3 , nitơ có cộng hoá trị lớn hơn cộng hoá trị của oxi

a: Cấu tạo nguyên tử của A là 11 proton và 11 electron
Cấu hình: \(1s^22s^22p^63s^1\)
Vị trí: Chu kì 3, nhóm IA
b: A là kim loại vì có 1 e lớp ngoài cùng

\(M_X=71.2=142\left(amu\right)\)
<=> \(2M+96=142\Rightarrow M=23\)
Kim loại M là sodium, hóa trị của M trong hợp chất là hóa trị I

a. Gọi hóa trị của Fe là a ta có 1 x a = 1 x II ( Theo quy tắc hóa trị )
Suy ra a = II hay hóa trị của Fe trong hợp chất là II
b. Gọi hóa trị của S là a ta có 1 x a = 3 x II ( Theo quy tắc hóa trị )
Suy ra a= IV hay hóa trị của S trong hợp chất là IV
a/ Đặt hóa trị của Fe trong hợp chất FeO là a
Vì O trong mọi hợp chất đều có hóa trị là 2
Theo qui tắc hóa trị, ta có:
\(1\times a=2\times1\Rightarrow a=2\)
Vậy hóa trị của Fe trong hợp chất FeO là 2
b/ Đặt hóa trị của S trong hợp chất SO3 là x
Vì O trong mọi hợp chất đều có hóa trị là 2
Theo qui tắc hóa trị ta có:
\(1\times x=2\times3\)
=> x = 6
Vậy hóa trị của S trong hợp chất SO3 là 6

\(M_X=71\cdot M_{H_2}=71\cdot2=142\)
=>\(2\cdot M+64+4\cdot16=142\)
=>\(2M=14\)
=>M=7
=>M là Li
Hóa trị của Li là I
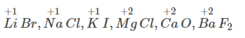


Trong các hợp chất NaCl và CaF 2 canxi (Ca) có điện hoá trị lớn hơn điện hoá trị của natri (Na).