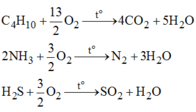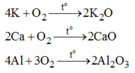Viết phương trình hóa học của phản ứng giữa với: 3 phi kim, thí dụ như C, S, P,…
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

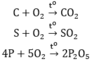

Câu 1:
+ Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt
2Cu+O2to→2CuO2Cu+O2→to2CuO
+ Tác dụng với Hiđro, Phản ứng có thể gây nổ mạnh nếu tỉ lệ phản ứng O2:H2 = 1:2
O2+2H2to→2H2OO2+2H2→to2H2O
+ Tác dụng với một số phi kim khác:
4P+5O2to→2P2O54P+5O2→to2P2O5
+ Tác dụng với một số hợp chất:
C2H5OH+3O2to→2CO2+3H2OC2H5OH+3O2→to2CO2+3H2O
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
3Fe+2O2to→Fe3O43Fe+2O2→toFe3O4
+ Phản ứng phân hủy là PƯHH trong đó có 2 hay nhiều chất được tạo thành từ một chất ban đầu.
2KClO3to→3O2↑+2KCl

Cl 2 có tính phi kim mạnh hơn S nên phản ứng dễ dàng với Fe và oxi hoá Fe lên hoá trị III, còn S tác dụng với Fe khi đốt nóng và oxi hoá Fe đến hoá trị II.
2Fe + 3 Cl 2 → 2Fe Cl 3
Fe + S → FeS
Có thể dự đoán được là Cl 2 có thể đẩy được S ra khỏi H 2 S :
Cl 2 + H 2 S → 2HCl + S

a,Na+O2->2Na2O;2Mg+O2->2MgO;2Fe+3O2->Fe2O3
b,C+O2->CO2;S+O2->SO2;4P+5O2->2P2O5
c,
tự làm thì sẽ nhớ lâu hơn bạn àh, câu này là kiến thức cơ bản, cần phải nắm vững tính chất là sẽ làm được
a)
4Na+O2\(\overset{t^0}{\rightarrow}\)2Na2O
2Ca+O2\(\overset{t^0}{\rightarrow}\)2CaO
4Al+3O2\(\overset{t^0}{\rightarrow}\)2Al2O3
b)
C+O2\(\overset{t^0}{\rightarrow}\)CO2
S+O2\(\overset{t^0}{\rightarrow}\)SO2
4P+5O2\(\overset{t^0}{\rightarrow}\)2P2O5
c)
2C4H10+13O2\(\overset{t^0}{\rightarrow}\)8CO2+10H2O
4NH3+3O2\(\overset{t^0}{\rightarrow}\)2N2+6H2O
2H2S+3O2\(\overset{t^0}{\rightarrow}\)2SO2+2H2O

\(CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ Fe_2O_3 + H_2 \xrightarrow{t^o} 2Fe + 3H_2O\\ FeO + H_2 \xrightarrow{t^o} Fe + H_2O\\ PbO + H_2 \xrightarrow{t^o} Pb + H_2O\\ Fe_3O_4 + 4H_2 \xrightarrow{t^o} 3Fe + 4H_2O\)

\(2Al+3S\underrightarrow{t^0}Al_2S_3\)
\(Fe+S\underrightarrow{t^0}FeS\)
\(Pb+S\underrightarrow{t^0}PbS\)
\(2Na+S\underrightarrow{t^0}Na_2S\)
a) 2 Al + 3 S -to-> Al2S3
b) Fe + S -to-> FeS
c) Pb + S -to-> PbS
d) 2 Na + S -to-> Na2S

a,
\(S+O_2\underrightarrow{^{to}}SO_2\)
\(2Al+3O_2\rightarrow2Al_2O_3\)
\(4K+O_2\rightarrow2K_2O\)
\(C+O_2\underrightarrow{^{to}}CO_2\)
\(2Cu+O_2\rightarrow2CuO\)
\(2Mg+O_2\rightarrow2MgO\)
b,
\(2CH_4+O_2\rightarrow2CO+4H_2\) hoặc \(CH_4+2O_2\rightarrow CO_2+2H_2O\)
\(2C_2H_2+O_2\rightarrow4CO_2+2H_2O\)
\(2C_4H_{10}+5O_2\rightarrow4CH_3COOH+2H_2O\)