Cho hỗn hợp chứa BaO và K hòa tan hòa tan vào lượng nước dư, thu được sản phẩm gồm:
A. KOH
B. Ba(OH)2
C. KOH, Ba(OH)2
D. KOH, Ba(OH)2, H2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PT: \(2K+2H_2O\rightarrow2KOH+H_2\)
\(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
\(K_2O+H_2O\rightarrow2KOH\)
\(BaO+H_2O\rightarrow Ba\left(OH\right)_2\)
Ta có: \(n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\)
Theo PT, có: \(\Sigma n_{H_2}=\dfrac{1}{2}n_K+n_{Ba}\)
\(\Rightarrow n_K+2n_{Ba}=0,04\left(1\right)\)
Ta có: \(n_{KOH}=\dfrac{2,24}{56}=0,04\left(mol\right)\)
Theo PT: \(\Sigma n_{KOH}=n_K+2n_{K_2O}\)
\(\Rightarrow n_K+2n_{K_2O}=0,04\left(2\right)\)
Từ (1) và (2) \(\Rightarrow n_K+2n_{Ba}=n_K+2n_{K_2O}\) \(\Rightarrow n_{Ba}=n_{K_2O}=\dfrac{0,04-n_K}{2}\) (3)
Mà: mA = 4,62 (g)
\(\Rightarrow39n_K+137n_{Ba}+94n_{K_2O}+153n_{BaO}=4,62\) (4)
Từ (3) và (4) \(\Rightarrow2n_{BaO}=n_K\) (5)
Từ (1) và (5) \(\Rightarrow n_{BaO}+n_{Ba}=\dfrac{0,04}{2}=0,02\left(mol\right)\)
Theo PT: \(\Sigma n_{Ba\left(OH\right)_2}=n_{Ba}+n_{BaO}=0,02\left(mol\right)\)
\(\Rightarrow m_{Ba\left(OH\right)_2}=0,02.171=3,42\left(g\right)\)
Tuy cách này vận dụng toán nhiều hơn hóa nhưng bạn tham khảo nhé!
Coi A gồm : K,Ba,O
Ta có : \(n_K = n_{KOH} = \dfrac{2,24}{56} = 0,04(mol)\)
Gọi :\(\left\{{}\begin{matrix}n_{Ba}=a\left(mol\right)\\n_O=b\left(mol\right)\end{matrix}\right.\)⇒ 137a + 16b = 4,62 - 0,04.39 = 3,06(1)
Bảo toàn e :
\(n_K + 2n_{Ba} = 2n_{H_2} + 2n_O\\ \Rightarrow 2a - 2b = 0(2)\)
Từ (1)(2) suy ra a = 0,02 ; b = 0,02
Vậy :
\(n_{Ba(OH)_2} = n_{Ba} = 0,02(mol)\\ \Rightarrow m_{Ba(OH)_2} = 0,02.171 = 3,42(gam)\)

Đáp án A
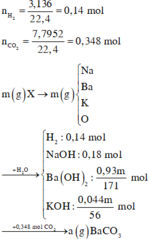
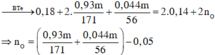
m = 23 . 0 , 18 + 137 . 0 , 93 m 171 + 39 . 0 , 44 m 56 + 16 n o
=> m - 23 . 0 , 18 + 137 . 0 , 93 m 171 + 39 . 0 , 044 56 + 16 0 , 93 m 171 + 0 , 044 56 - 0 , 05
=> m = 25,5 g

Giá trị a gần nhất với giá trị 25,5

Đáp án : C
Nếu ta đốt cháy X tạo hỗn hợp T toàn oxit thì lượng mol nguyên tố kim loiaj không đổi
=> nH2 = nO pứ = 0,14 mol => moxit = mX + mO pứ = m + 2,24 (g)
Y : nNaOH = 0,18 => nNa2O = 0,09 mol
,nBa(OH)2 = nBaO = 31m/5700 ; nK2O = ½ nKOH = 5,5m/14000
=> mT = mBaO + mNa2O + mK2O
=> m = 25,5g
=> nOH = 0,4774 mol
,nCO2 = 0,348 mol
=> nCO3 = nOH – nCO2 = 0,1294 mol < nBa = 0,1387 mol
=> nBaCO3 = 0,1294
=>a = 25,49g

\(n_{KOH}=a\left(mol\right)\)
\(n_{H_2}=\dfrac{0.672}{22.4}=0.03\left(mol\right)\)
\(n_{H_2O}=\dfrac{1}{2}n_{KOH}+n_{Ca\left(OH\right)_2}+2n_{H_2}=0.5a+0.01+2\cdot0.03=0.5a+0.07\left(mol\right)\)
\(BTKL:\)
\(m_X+m_{H_2O}=m_{Ca\left(OH\right)_2}+m_{KOH}+m_{H_2}\)
\(\Rightarrow2.43+\left(0.5a+0.07\right)\cdot18=0.01\cdot74+56a+0.03\cdot2\)
\(\Rightarrow a=0.06\)
\(m_{KOH}=0.06\cdot56=3.36\left(g\right)\)
Đáp án: D