Người ta cho kẽm hoặc sắt tác dụng với dung dịch axit clohidric HCl để điều chế khí hidro. Nếu muốn điều chế 2,24l khí hidro (đktc) thì phải dùng số gam kẽm hoặc sắt lần lượt là:
A. 6,5g và 5,6g B. 16g và 8g
C. 13g và 11,2g D. 9,75g và 8,4g
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

giả sử 2 kim loại cùng 1 khối lượng là a , ta có
\(2Al+6HCl->2AlCl_3+3H_2\)
(mol) \(\frac{a}{27}\) \(\frac{a}{18}\)
\(Fe+2HCl->FeCl_2+H_2\)
(mol) \(\frac{a}{56}\) \(\frac{a}{56}\)
vì \(\frac{a}{56}< \frac{a}{18}\) => cùng 1 khối lượng như nhau , Al cho thể tích khí hidro nhiều hơn Fe

`Fe + 2HCl -> FeCl_2 + H_2 \uparrow`
`0,1` `0,2` `0,1` `0,1` `(mol)`
`n_[Fe]=[5,6]/56=0,1(mol)`
`a)V_[H_2]=0,1.22,4=2,24(l)`
`b)C_[M_[HCl]]=[0,2]/[0,1]=2(M)`
Anh cho em hỏi muốn tính được CM thì lấy số mol của chất tan chia cho thể dung dịch sao anh lấy số mol của dd chia cho thể tích của dd vậy ạ em chưa hiểu lắm

a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, Ta có: \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c, PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Theo PT: \(n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{1}{15}\left(mol\right)\Rightarrow m_{Fe}=\dfrac{1}{15}.56=\dfrac{56}{15}\left(g\right)\)

Phương trình hóa học của phản ứng:
Fe + H2SO4 → FeSO4 + H2.
Zn + H2SO4 → ZnSO4 + H2.
Fe + 2HCl → FeCl2 + H2.
Zn + 2HCl → ZnCl2 + H2.
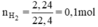
Theo phương trình (3) mFe cần dùng: 56.0,1 = 5,6g.
Theo phương trình (4) mZn cần dùng: 65.0,1 = 6,5g.

![]()
Để điều chế 0,05 mol H 2 thì:
n Z n = n M g = 0,05 mol mà M M g < M Z n
⇒ Dùng Mg sẽ cần khối lượng nhỏ hơn
n H C l = 2 . n H 2 = 0,05 . 2 = 0,1 mol ⇒ m H C l = 0,1 . 36,5 = 3,65 g
n H 2 S O 4 = n H 2 = 0,05 mol ⇒ m H 2 S O 4 = 0,05 .98 = 4,9g
⇒ Dùng axit HCl sẽ cần khối lượng nhỏ hơn
Nên với những chất đã cho muốn dùng với khối lượng nhỏ nhất để điều chế H 2 ta dùng Mg và axit HCl

a) \(n_{Fe}=\dfrac{28}{56}=0,5\left(mol\right);n_{Zn}=\dfrac{32,5}{65}=0,5\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,5 1 0,5
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: 0,5 1 0,5
\(V_{H_2}=\left(0,5+0,5\right).22,4=22,4\left(l\right)\)
b, \(m_{HCl}=\left(1+1\right).36,5=73\left(g\right)\)

nFe = 0.5 (mol)
nZn = 0.5 (mol)
Fe + 2HCl → FeCl2 + H2↑
0.5 1 0.5
Zn + 2HCl → ZnCl2 + H2↑
0.5 1 0.5
=> Tổng nH2 = 1 (mol) => VH2 = 22.4x1=22.4 (l)
b) Tổng nHCl = 2 (mol) => mHCl = 2x36.5=73 (g)

a) Zn + 2HCl --> ZnCl2 + H2
b) \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
_____0,15<-------------------0,15
=> mZn = 0,15.65 = 9,75(g)
c) \(n_{HCl}=\dfrac{3,65}{36,5}=0,1\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
__________0,1------------->0,05
=> VH2 = 0,05.22,4 = 1,12(l)
Chọn A.