Cho 8,5g hỗn hợp Na và K tác dụng với nước thu được 3,36l khí hidro (đktc) và dung dịch X. Cho X tác dụng vừa đủ với dung dịch F e 2 S O 4 3 thu được m(g) kết tủa. Giá trị của m là:
A. 5,35g
B. 16,05g
C. 10,70g
D. 21,40g
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
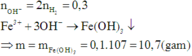
Nhận xét:Ở bài này, giả thiết cho thừa dữ kiện về tổng khối lượng hai kim loại. Đề bài sẽ hay hơn khi thay một trong hai kim loại kiềm trong hỗn hợp bằng kim loại Ba, khi đó kết tủa tạo thành gồm Fe(OH)3 và BaSO4. Để tính n F e ( O H ) 3 ta vẫn có cách làm như trên, tuy nhiên để tính được n B a S O 4 thì ta cần biết nBa , khi đó ta cần lập và giải hệ 2 phương trình bậc nhất 2 ẩn là nBa và nNa (hoặc nK ) theo giả thiết về khối lượng và n H 2 .

Đáp án B
Các phản ứng tạo kết tủa:
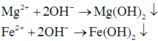
Dung dich X có ![]()
Dung dịch Y có ![]()
Mà ![]() nên OH-dư và
nên OH-dư và ![]()
Vậy ![]()

\(n_{H_2}=\dfrac{2.464}{22.4}=0.11\left(mol\right)\)
\(n_{NaCl}=\dfrac{22.23}{58.5}=0.38\left(mol\right)\)
Quy đổi hỗn hợp thành : Na , K và O.
\(n_{Na}=n_{NaCl}=0.38\left(mol\right)\)
Bảo toàn e :
\(n_{Na}+n_K=2n_O+2n_{H_2}\)
\(\Rightarrow n_K-2n_O=-0.16\left(1\right)\)
Bảo toàn khối lượng :
\(23\cdot0.38+39n_K+16n_O=30.7\left(g\right)\)
\(\Rightarrow39n_K+16n_O=21.96\left(2\right)\)
\(\left(1\right),\left(2\right):n_K=0.44,n_O=0.3\)
\(m_{KCl}=0.44\cdot74.5=32.78\left(g\right)\)
Quy đổi 2 kim loại kiềm Na và K là 1 kim loại trung bình . Khi đó:
2 M ¯ + 2 H 2 O → 2 M ¯ O H H 2 1 6 M ¯ O H + F e 2 S O 4 3 → 3 M ¯ 2 S O 4 + 2 F e O H 3 ( 2 )
Theo bài ta có: n H 2 = 3,36 22,4 = 0,15 m o l
⇒ n M ¯ O H = 2. n H 2 = 2.0,15 = 0,3 m o l ⇒ n F e ( O H ) 3 = 1 3 n M ¯ O H = 1 3 .0,3 = 0,1 m o l
⇒ m ↓ = m F e ( O H ) 3 = 0,1.107 = 10,7 g a m
⇒ Chọn C.