Trộn 200 ml dung dịch Ca(H2PO4)2 1M với 200 ml dung dịch Ca(OH)2 1M. Khối lượng kết tủa thu được là:
A. 31
B. 45
C. 54,4
D. 54
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C.
OH– + HCO3– ® CO32– + H2O
1,2 0,5 0,5
Ca2+ + CO32– ® CaCO3
0,6 0,5 0,5
⇒ m C a C O 3 = 50 g

Đặt \(\left\{{}\begin{matrix}n_{CaCO_3}=a\left(mol\right)\\n_{Ca\left(HCO_3\right)_2}=b\left(mol\right)\end{matrix}\right.\)
Theo đề: \(\left\{{}\begin{matrix}100a=10\\a+b=0,2\end{matrix}\right.\Leftrightarrow a=b=0,1\rightarrow n_{CO_2}=0,3\left(mol\right)\)
\(PTHH:C_6H_{12}O_6\underrightarrow{men}2CO_2+2C_2H_5OH\)
(mol) 0,15 0,3
\(H=80\%\Rightarrow n_{C_6H_{12}O_6}=0,1875\left(mol\right)\Rightarrow m=33,75\left(g\right)\)
\(\rightarrow A\)

• 0,1 mol HCl + 0,02 mol Al2(SO4)3 → ddX
ddX + 0,125 mol Ba(OH)2 → ↓
• 2HCl + Ba(OH)2 → BaCl2 + 2H2O (*)
Al2(SO4)3 + 3Ba(OH)2 → 2Al(OH)3↓ + 3BaSO4↓ (**)
2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O (***)
Theo (*) nBa(OH)2 = 0,1 : 2 = 0,05 mol.
Theo (**) nBa(OH)2 = 0,02 × 3 = 0,06 mol; nAl(OH)3 = 0,04 mol; nBaSO4 = 0,06 mol.
Theo (***) nBa(OH)2 = 0,125 - 0,05 - 0,06 = 0,015 mol → nAl(OH)3 = 0,04 - 0,015 × 2 = 0,01 mol.
→ m↓ = mBaSO4 + mAl(OH)3 = 0,06 × 233 + 0,01 × 78 = 14,76 gam
→ Đáp án đúng là đáp án C

Chọn D.
nBa(OH)2 đầu = 0.15 => nOH- = 0.3
nAl2(SO4)3 = 0.25x => nAl3+ = 0.5x và nSO4(2-) = 0.75x
Khi cho 150ml Ba(OH)2 vào dd thu được 42.75g kết tủa
Thêm tiếp 200ml
=> m kết tủa theo lí thuyết = 350*42.75/150 = 99.75g > 94.2375g
=> Lúc đầu chưa tạo kết tủa cực đại, Al2(SO4)3 dư ; sau khi thêm Ba(OH)2 vào thì pứ tạo kết tủa
lớn nhất và sau đó Ba(OH)2 dư sẽ hòa tan thêm một phần kết tủa
+ Khi chưa thêm: (tính theo nBa(OH)2)
Ba2+ + SO42- ---> BaSO4
0.15 0.15 0.15
Al3+ + 3OH- ----> Al(OH)3
0.1 0.3 0.1
+ Khi thêm Ba(OH)2 vào: (tính theo nAl2(SO4)3)
Ba2+ + SO42- ---> BaSO4
0.75x-0.15 0.75x-0.15
Al3+ + 3OH- ---> Al(OH)3
0.5x-0.1 1.5x-0.3 0.5x-0.1
OH- dư + Al(OH)3 --->AlO2- + 2 H2O
0.4-1.5x+0.3 0.7-1.5x
Ta có:
m kết tủa lúc sau = m kết tủa ban đầu + mBaSO4 sau + mAl(OH)3 chưa tan lúc sau = 42.75 + 233*(0.75x-0.15) +
78*(0.5x-0.1-0.7+1.5x)
=> 330.75x - 54.6 = 94.2375
=> x = 0.45

Chọn đáp án C
Chú ý :
(1). Trong bài toán này người ta không vớt kết tủa lần đầu ra mà cứ để yên rồi đổ thêm Ba(OH)2 vào.
(2). Để mò ra đáp án nhanh bài toán này các bạn cần tư duy nhanh xem lượng kết tủa ở lần 1 và 2 có bị tan phần nào không.Điều này khá đơn giản.
+Nhìn nhanh qua đáp án cũng khẳng định được ở lần 1 muối sunfat có dư.
+Khi đổ thêm Ba(OH)2 dễ thấy Al(OH)3 bị tan vì khi x = 0,45 vẫn bị tan
Khi đó ta có
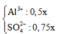
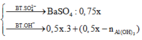
![]()
![]()
Vậy
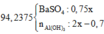
![]()
![]()
Bài này các bạn cũng có thể dùng thủ đoạn truyền thống “thử đáp án”

Chọn A.
Các dung dịch lần lượt là (1), (2), (3) lần lượt là AlCl3, H2SO4, Al2(SO4)3
Khi cho 1 mol H2SO4 và 1 mol Al2(SO4)3 Þ b = 4 + 2 = 6 Þ b = 6a

\(n_{K_2SO_4}=1\cdot0,2=0,2\left(mol\right)\\ n_{BaCl_2}=2\cdot0,15=0,3\left(mol\right)\\ PTHH:K_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2KCl\\ \text{Vì }\dfrac{n_{K_2SO_4}}{1}< \dfrac{n_{BaCl_2}}{1}\text{ nên sau p/ứ }BaCl_2\text{ dư}\\ \Rightarrow n_{BaSO_4}=n_{K_2SO_4}=0,2\left(mol\right)\\ \Rightarrow m_{\downarrow}=m_{BaSO_4}=0,2\cdot233=46,6\left(g\right)\)
Đáp án C
nH2PO4(2-)=0,4 mol; nOH-= 0,4 mol; nCa2+=0,4 mol
H2PO4-+ OH-→ HPO42-+ H2O
0,4 0,4 0,4
Ca2++ HPO42-→ CaHPO4
0,4 0,4 0,4
mCaHPO4= 0,4. 136= 54,4 gam