Hòa tan hoàn toàn 56g sắt bằng dung dịch axit clohiđric(HCl), phản ứng kết thúc thu được muối sắt clorua F e C l 2 và khí hiđro. Tính khối lượng axit clohiđric(HCl) đã tham gia phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

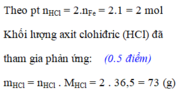

BTKL: \(m_{Fe}+m_{HCl}=m_{muối}+m_{H_2}\)
\(\Rightarrow m_{H_2}=5,6+7,3-12,7=0,2\left(g\right)\)

Gọi \(n_{Fe}=x\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{FeCl_2}=n_{Fe}=x\left(mol\right)\)
Vì khối lượng muối FeCl2 tăng 7,1g so với khối lượng bột Fe
\(\Rightarrow127x-56x=7,1\\ \Rightarrow x=0,1\)
\(n_{H_2}=n_{Fe}=0,1\left(mol\right)\\ V_{H_2\left(ĐKTC\right)}=0,1.22,4=2,24\left(l\right)\)
Chọn D

\(a,\text{Sơ đồ p/ứ: }Fe+HCl\to FeCl_2+H_2\\ b,PTHH:Fe+2HCl\to FeCl_2+H_2\\ c,\text{Bảo toàn KL: }m_{Fe}+m_{HCl}=m_{FeCl_2}+m_{H_2}\\ \Rightarrow m_{HCl}+56=150+8=158\\ \Rightarrow m_{HCl}=102(g)\)

Áp dụng ĐLBTKL, ta có:
\(m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\)
\(\Leftrightarrow3,25+m_{HCl}=6,8+0,1\)
\(\Leftrightarrow m_{HCl}=6,8+0,1-3,25=3,65\left(g\right)\)

\(n_{H2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a) \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,15 0,15 0,15
b) \(n_{Fe}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(m_{Fe}=01,5.56=8,4\left(g\right)\)
c) \(n_{FeCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{FeCl2}=0,2.127=25,4\left(g\right)\)
Chúc bạn học tốt


