Hòa tan 10 gam C a C O 3 vào dung dịch C H 3 C O O H dư. Thể tích C O 2 thoát ra ( đktc) là
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 5,60 lít
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

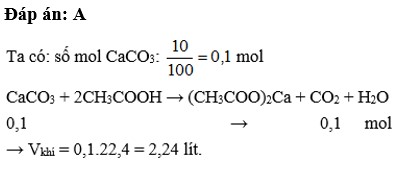

Gọi số mol của N2O, CO2, C3H8 là a, b, c
=> \(\left\{{}\begin{matrix}a+b+c=\dfrac{3,36}{22,4}=0,15\\44a=44b=44c\end{matrix}\right.\)
=> a = b = c = 0,05 (mol)
Khí thoát ra gồm N2O, C3H8
=> V = (0,05 + 0,05).22,4 = 2,24(l)
=> A
Gọi số mol của N2O, CO2, C3H8 là a, b, c
=> ⎧⎪⎨⎪⎩a+b+c=3,3622,4=0,1544a=44b=44c{a+b+c=3,3622,4=0,1544a=44b=44c
=> a = b = c = 0,05 (mol)
Khí thoát ra gồm N2O, C3H8
=> V = (0,05 + 0,05).22,4 = 2,24(l)
=> A

Cho 16,2 gam kim loại M có hóa trị n tác dụng với 0,15 mol O2. Chất rắn thu được sau phản ứng đem hòa tan vào dung dịch HCl dư thấy thoát ra 13,44 lít H2 (đktc). Kim loại M là
A. Fe
B. Al
C. Ca
D. Mg

Chọn B
Cho hỗn hợp chất rắn phản ứng với HCl dư có Cu không phản ứng.
Phương trình hóa học:
F e + 2 H C l → F e C l 2 + H 2 F e O + 2 H C l → F e C l 2 + H 2 O


1)
Ta có : \(m_X=1,225\times32=39,2\left(g\right)\)
Giả sử có 1 mol X , gọi số mol của \(CO_2\)là a
Ta có : \(n_{N_2}=1-a\left(mol\right)\)
Ta có phương trình sau :
\(44a+28\left(1-a\right)=39,2\)
\(\Leftrightarrow44a+28-28a=39,2\)
\(\Leftrightarrow16a=11,2\)
\(\Leftrightarrow a=0,7\)
Vậy số mol của \(CO_2\) trong hỗn hợp X là 0,7 mol
\(\Rightarrow n_{N_2}=1-0,7=0,3\left(mol\right)\)
\(\Rightarrow\hept{\begin{cases}\%n_{CO_2}=70\%\\\%n_{N_2}=30\%\end{cases}}\)
Mà ở cùng một điều kiện về nhiệt đọ và áp suất, tỉ lệ số mol bằng tỉ lệ về thể tích
\(\Rightarrow\hept{\begin{cases}\%V_{CO_2}=70\%\\\%V_{N_2}=30\%\end{cases}}\)
Vậy \(\%V_{N_2}\) trong hỗn hợp X là 30%

Chọn A.
Có m(hh khí) = 6,11; n(hh khí) = 0,13
=> n(Cl2) = 0,05; n(O2) = 0,08.
Hòa tan hết Y trong HCl nên có: n(HCl) = 2.n(H2O) = 2.n(O2-) = 0,32 mol
- BTNT (Cl):
n(Cl- trong Z) = n(AgCl) = n(HCl) + n(Cl-) = 0,32 + 0,1 = 0,42. → m(AgCl) = 0,42.143,5 = 60,27 gam
→ m(kết tủa) = m(AgCl) + m(Ag) → m(Ag) = 73,23 – 60,27 = 12,96 → n(Ag) = 0,12 mol.
=> n(Fe2+) = 0,12.
BTĐT trong Z: 2.0,12 + 2.n(Cu) = 0,42 => n(Cu) = 0,09.
Vậy X chứa Fe (0,12) và Cu(0,09).
Khi X tác dụng HNO3, ta thấy: (0,12 × 3 + 0,09 × 2) ÷ 3 = 0,18 mol > n(NO) = 0,15 mol
có nghĩa là Fe không lên hết Fe3+ mà có 1 phần chỉ lên Fe2+
Khi phản ứng với HNO3: nFe(III) = a mol ; nFe(II) = bmol. ta có hệ:
a + b = 0,12
3a + 2b + 0,09.2 = 0,15.3
Giải hệ: a = 0,03; b = 0,09.
Vì HNO3 dùng hết, n(HNO3) = 4n(NO) = 0,6 mol → m(HNO3) = 37,8 → m(dd HNO3) = 120 gam.
→ BTKL: m(dd T) = m(X) + m(HNO3) – m(NO) = 127,98 gam.
C%(Fe(NO3)3 trong T) = 0,03 . 242 : 127,98 ≈ 5,67%.