cho hỗn hợp gồm đồng và sắt tác dụng một với một lượng dung dịch axit sunfuric loãng thu được 6,72 lít khí hidro ở điều kiện tiêu chuẩn và chất rắn a đem nung A trong trong không khí đến khối lượng không đổi cân được 4 g tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp cu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


PTHH: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
\(Cu+2H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}CuSO_4+SO_2\uparrow+2H_2O\)
Ta có: \(n_{SO_2}=\dfrac{0,112}{22,4}=0,005\left(mol\right)=n_{Cu}\)
\(\Rightarrow m_{Cu}=0,005\cdot64=0,32\left(g\right)\) \(\Rightarrow m_{Mg}=10,6-0,32=10,28\left(g\right)\)

a) PTHH : Fe + S \(\rightarrow\) FeS
=> A gồm : Fe , FeS
Fe + 2 HCl -> FeCl2 + H2
FeS + 2 HCL -> FeCl2 + H2S
=> Y gồm : H2 , H2S
nY = n H2 + n H2S = 0,1 mol (I)
dY/H2 = 13 -> m Y = 2.nH2 + 34.n H2S = 13.2.0,1 = 2,6 g (II)
Từ (I),(II) => n H2 = 0,025 mol ; n H2S = 0,075 mol
Fe + 2 HCl \(\rightarrow\) FeCl2 + H2
0,025<---------------------0,025 mol
FeS + 2 HCl \(\rightarrow\) FeCl2 + H2S
0,075<-------------------------0,075 mol
Ta có: n S = n Fe phản ứng = n FeS = 0,075 mol
=>m S =0,075.32 = 2,4 g
n Fe ban đầu = 0,075 + 0,025 = 0,1mol
=>m Fe=0,1.56 = 5,6 g
=> %m S = \(\dfrac{2,4}{2,4+5,6}.100=30\%\)
=> %m Fe = 100 - 70 = 30%
b ) 2 H2 + O2 \(\rightarrow\) 2 H2O
0,025-------------->0,025 mol
2 H2S + 3 O2 \(\rightarrow\) 2 SO2 + 2 H2O
0,075--------------->0,075--->0,075 mol
m H2O2 = 5,1 g -> n H2O2 = 0,15 mol
PTHH : SO2 + H2O2 \(\rightarrow\) H2SO4
Ban đầu :0,075---->0,15 mol
Phản ứng:0,075--->0,075------>0,075 mol
Sau phản ứng:0----->0,075----->0,075 mol
m dd sau phản ứng = 18.(0,025 + 0,075 ) + 64.0,075 + 100 = 106,6 g
m H2O2 dư = 0,075.34 =2,55g
\(\Rightarrow C\%_{H_2O_2dư}=\dfrac{2,55}{106,6}.100=2,392\%\)
m H2SO4 = 0,075.98 = 7,35g
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{7,35}{106,6}.100=6,895\%\)

a, \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O\)
Khí A: SO2 - lưu huỳnh đioxit
b, Đề có cho thể tích khí A không bạn nhỉ?

Đáp án D
Dung dịch B mất màu hoàn toàn => Cu2+ phản ứng hết
3 kim loại là Ag, Cu, Fe dư.
mFe dư =55,2-108.0,4-64.0,1=5,6 gam
Đặt số mol Mg và Fe phản ứng lần lượt là x, y
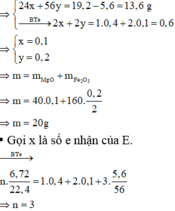
=> Khí E là NO

Chất rắn không tan là Cu.
\(Fe + H_2SO_4 \to FeSO_4 + H_2\)
Ta có :
\(n_{Fe} = n_{H_2} = \dfrac{4,48}{22,4} = 0,2(mol)\\ \Rightarrow m_{Fe} = 0,2.56 = 11,2(gam)\\ \Rightarrow m_{Cu} = 15,2 - 11,2 = 4(gam)\)

Sửa đề: 6,4 gam hh \(\rightarrow\) 6,45 gam hh
a) Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+27b=6,45\) (1)
Ta có: \(n_{H_2}=\dfrac{7,28}{22,4}=0,325\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,65\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{Mg}=0,1\left(mol\right)\\b=n_{Al}=0,15\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1\cdot24}{6,4}\cdot100\%=37,5\%\\\%m_{Mg}=62,5\%\end{matrix}\right.\)
b) Ta thấy với 6,45 gam hh thì có 0,1 mol Mg và 0,15 mol Al
\(\Rightarrow\) Trong 12,9 gam hh thì chứa 0,2 mol Mg và 0,3 mol Al
Gọi \(n_{SO_2}=x\left(mol\right)\)
Bảo toàn electron: \(2\cdot0,2+3\cdot0,3=2x\) \(\Rightarrow x=n_{SO_2}=0,65\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,65\cdot22,4=14,56\left(l\right)\)
gọi số mol của Mg là x mol ; Al là y mol => 24x + 27y =6,4
n khí = 7,28/22,4=0,325 mol
bảo toàn e ta có
Mg + H2SO4 --> MgSO4 + H2
x x mol
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
y 3/2 y mol
=> x + 3/2y=0,325
=> x=11/120 mol ; y=7/45 mol
=> mMg11/120*24=2,2g => %mMg = 2,2*100/6,4=34,375%
=>%mAl=100-34,375=65,625%

Đáp án C
· X gồm 0,2539m (g) O và 0,7461m (g) kim loại.
· Hỗn hợp khí Z gồm CO dư và CO2
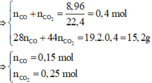
Þ Y gồm 0,7461m (g) kim loại và 0,2539m – 16.0,25 = 0,2539m – 4 (g) O
· Y + HNO3 → 0,32 mol NO + 3,456m g muối
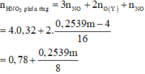
Þ Dung dịch T chứa
n NO 3 - = 0 , 78 + 0 , 2359 m 8 - 0 , 32 = 0 , 46 + 0 , 2359 m 8 ⇒ m muối = 0 , 7461 m + 62 . 0 , 46 + 0 , 2359 m 8 = 3 , 456 m ⇒ m = 38 , 43 g
Gần nhất với giá trị 38

Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n Cu = n SO 2 = 0 , 075 mol.
Đặt n Cr = x mol; n Fe = y mol → m X 52x + 56y + 0,075 × 64 = 18,2 gam.
x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
mCr trong X = 42,86% và %mCu trong X = 26,37%
Đáp án A
PTHH:
Cu + H2SO4 ---x--->
Fe + H2SO4 ---> FeSO4 + H2 (1)
2Cu + O2 ---to---> 2CuO (2)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT(1): \(n_{Fe}=n_{H_2}=0,3\left(mol\right)\)
=> \(m_{Fe}=0,3.56=16,8\left(g\right)\)
Ta có: \(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
Theo PT(2): \(n_{Cu}=n_{CuO}=0,05\left(mol\right)\)
=> \(m_{Cu}=0,05.64=3,2\left(g\right)\)
=> \(\%_{m_{Cu}}=\dfrac{3,2}{3,2+16,8}.100\%=16\%\)
\(\%_{m_{Fe}}=100\%-16\%=84\%\)