Cho 4,48 lít khí CO (đktc) tác dụng với FeO ở nhiệt độ cao. Sau phản ứng thu được chất rắn A có khối lượng nhỏ hơn 1,6g so với lượng FeO ban đầu. Tính khối lượng Fe thu được và % V các chất (cùng trạng thái) sau phản ứng?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nCO phản ứng = nCO2 = nFe = nO = 0,1
→ mFe = 5,6g
nCO2 dư = 0,2 - 0,1 = 0,1
→ %VCO2 = 50%
FeO + CO -> Fe + CO2
nCO=0,2(mol)
Đặt nFeO tham gia PƯ=a
Ta có:
72a-56a=1,6
=>a=0,1
Theo PTHH ta có:
nFe=nCO2=nFeO tham gia PƯ=0,1(mol)
mFe=56.0,1=5,6(g)
%VCO2=\(\dfrac{0,1}{0,2}.100\%=50\%\)
%VCO=100-50=50%

Đặt :
nFeO = x mol
FeO + CO -to-> Fe + CO2
x_____x_______x_____x
m giảm = mFeO - mFe = 1.6
<=> 72x - 56x = 1.6
=> x = 0.1
mFe = 0.1*56 = 5.6 g
nCO dư = 0.2 - 0.1 = 0.1 mol
nCO2 = 0.1 mol
Vì : %V = %n
%CO = %CO2 = 0.1/0.2 *100% = 50%
Đặt \(n_{FeO}=x\left(mol\right)\)
\(FeO+CO\underrightarrow{t^o}Fe+CO_2\)
x → x
\(m_{giảm}=m_{FeO}-m_{Fe}=1,6\)
\(\Leftrightarrow72x-56x=1,6\)
\(\rightarrow x=0,1\)\(\rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
\(n_{CO}dư=0,2-0,1=0,1\left(mol\right)\)
→\(n_{CO_2}=0,1\left(mol\right)\)
mà \(\%V=\%n\)
%CO=%CO2\(\frac{0,1}{0,2}\).100%=50%

Đáp án D
Các phản ứng xảy ra:
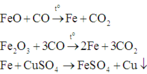
Hỗn hợp rắn thu được khi cho hỗn hợp phản ứng với dung dịch CuSO4 gồm Cu, FeO và Fe2O3.
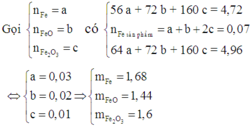

n HCl = 360 x 18,25/(100x36,5) = 1,8 mol
H 2 + CuO → t ° Cu + H 2 O
n CuO = x
Theo đề bài
m CuO (dư) + m Cu = m CuO (dư) + m Cu p / u - 3,2
m Cu = m Cu p / u - 3,2 => 64x = 80x - 3,2
=> x= 0,2 mol → m H 2 = 0,4g
Fe + 2HCl → FeCl 2 + H 2
Số mol HCl tác dụng với Fe 3 O 4 , Fe 2 O 3 , FeO là 1,8 - 0,4 = 1,4 mol
Phương trình hóa học của phản ứng:
Fe 3 O 4 + 8HCl → 2 FeCl 3 + FeCl 2 + 4 H 2 O (1)
Fe 2 O 3 + 6HCl → 2 FeCl 3 + 3 H 2 O (2)
FeO + 2HCl → FeCl 2 + H 2 O (3)
Qua các phản ứng (1), (2), (3) ta nhận thấy n H 2 O = 1/2 n HCl = 1,4:2 = 0,7 mol
Áp dụng định luật bảo toàn khối lượng, ta có:
m hỗn hợp + m HCl = m muối + m H 2 O + m H 2
57,6 + 1,8 x 36,5 = m muối + 0,7 x 18 +0,4
m muối = 57,6 + 65,7 - 12,6 - 0,4 = 110,3 (gam)

a, \(2Fe+O_2\underrightarrow{t^o}2FeO\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(4Fe+3O_2\underrightarrow{t^o}2Fe_2O_3\)
\(2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(2FeO+4H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+SO_2+4H_2O\)
\(2Fe_3O_4+10H_2SO_{4\left(đ\right)}\underrightarrow{t^o}3Fe_2\left(SO_4\right)_3+SO_2+10H_2O\)
\(Fe_2O_3+3H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3H_2O\)
b, Ta có: mO2 = 3,2 (g) \(\Rightarrow n_{O_2}=\dfrac{3,2}{32}=0,1\left(mol\right)\)
\(n_{SO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
BT e, có: 3nFe = 4nO2 + 2nSO2
⇒ nFe = 0,2 (mol)
⇒ mFe = 0,2.56 = 11,2 (g)
$FeO + CO \xrightarrow{t^o} Fe + CO_2$
Theo PTHH : $n_{FeO} = n_{CO\ pư} = n_{Fe} = n_{CO_2} = a(mol)$
$\Rightarrow m_{giảm} = m_{FeO} - m_{Fe} = 72a -56a = 16a = 1,6(gam)$
$\Rightarrow a = 0,1(mol)$
$m_{Fe} = 0,1.56 = 5,6(gam)$
$n_{CO\ dư} = 0,2 - 0,1 = 0,1(mol)$
$\%V_{CO\ dư} = \%V_{CO_2} = \dfrac{0,1}{0,1 + 0,1}.100\% = 50\%$
bn ơi sai r