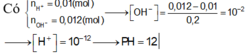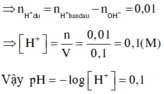Trộn 100ml dung dịch có pH=1 gồm HCl và H2SO4 với 100ml dung dịch KOH nồng độ x mol/lít, ghu được 200ml dung dịch có pH=13. Giá trị của x là (biết trong mọi dung dịch [H+] [OH-] = 10-14, bỏ qua sự điện li của nước)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Dung dịch axit ban đầu có [H+] = 0,1 M
⇒ nH+= 0,1.0,1 = 0,01 mol
Dung dịch sau phản ứng có pH = 12
⇒ dư bazơ và có pOH =14 – 12 = 2
⇒ [OH-] = 0,01M
⇒ nOH− dư = 0,002 mol
Phản ứng trung hòa:
nH+phản ứng = nOH−phản ứng = 0,01 mol
⇒ nNaOH ban đầu = nOH−phản ứng + nOH− dư
= 0,01 + 0,002 = 0,012 mol
⇒ a = 0,12M

2. Tính nồng độ mol/l của các dung dịch:
a) Dung dịch H2SO4 có pH = 4.
\(pH=4\Rightarrow\left[H^+\right]=10^{-4}M\)
=> \(CM_{H_2SO_4}=\dfrac{\left[H^+\right]}{2}=\dfrac{10^{-4}}{2}=5.10^{-5M}\)
b) Dung dịch KOH có pH = 11.
\(pH=11\Rightarrow pOH=14-11=3\)
=> \(\left[OH^-\right]=10^{-3}=CM_{KOH}\)
3. Pha loãng 200ml dung dịch Ba(OH)2 với 1,3 lít nước thu được dung dịch có pH = 12. Tính nồng độ mol/l của dung dịch Ba(OH)2 ban đầu, biết rằng Ba(OH)2 phân ly hoàn toàn.
Đặt CM Ba(OH)2 = xM
=> \(n_{Ba\left(OH\right)_2}=0,2x\left(mol\right)\)
\(V_{sau}=V_{Ba\left(OH\right)_2}+V_{H_2O}=0,2+1,3=1,5\left(l\right)\)
pH=12 => pOH=2 => \(\left[OH^-\right]=10^{-2}M\)
\(Ba\left(OH\right)_2\rightarrow Ba^{2+}+2OH^-\)
0,2x----------------------------->0,4x
=> \(\left[OH^-\right]=\dfrac{0,4x}{1,5}=10^{-2}\)
=> x=0,0375M
Vậy nồng độ mol/l của dung dịch Ba(OH)2 ban đầu là 0,0375M

Chọn B
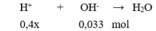
Dung dịch sau phản ứng có pH = 2 < 7 nên dung dịch sau phản ứng có H + dư
→ 0,4x – 0,033 = 10 - 2 .0,3 → x = 0,09

Ta có: \(pH=1\Rightarrow\left[H^+\right]=0,1\Rightarrow n_{H^+}=0,1.0,1=0,01\left(mol\right)\)
Sau pư, pH = 12 ⇒ OH- dư.
\(\Rightarrow\left[OH^-\right]_{\left(dư\right)}=\frac{10^{-14}}{10^{-12}}=0,01\Rightarrow n_{OH^-\left(dư\right)}=0,01.0,2=0,002\left(mol\right)\)
PT ion: \(H^++OH_{\left(pư\right)}^-\rightarrow H_2O\)
_______0,01 → 0,01 (mol)
\(\Rightarrow\Sigma n_{OH^-}=0,01+0,002=0,012\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\frac{0,012}{0,1}=0,12M=a\)
Bạn tham khảo nhé!

$n_{Ba^{2+}} = 0,1.0,5 = 0,05 < n_{SO_4^{2-}} = 0,1$ nên $SO_4^{2-}$ dư
$n_{BaSO_4} = n_{Ba^{2+}} = 0,05(mol)$
$m_{BaSO_4} = 0,05.233 = 11,65(gam)$
$n_{OH^-} = 0,1.0,5.2 + 0,1.0,5 = 0,15(mol)$
$n_{H^+} = 0,1.2 = 0,2(mol)$
$H^+ + OH^- \to H_2O$
$n_{H^+\ dư} = 0,2 - 0,15 = 0,05(mol)$
$V_{dd} = 0,1 + 0,1 + 0,1 = 0,3(lít)$
$[H^+] = \dfrac{0,05}{0,3} = \dfrac{1}{6}M$
$pH = -log( \dfrac{1}{6} ) = 0,778$
\(n_{Ba^{2+}}=0.1\cdot0.5=0.05\left(mol\right)\)
\(n_{OH^-}=0.1\cdot0.5\cdot2+0.1\cdot0.5=0.15\left(mol\right)\)
\(n_{H^+}=2\cdot0.1\cdot1=0.2\left(mol\right)\)
\(n_{SO_4^{2-}}=0.1\left(mol\right)\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
\(0.05.........0.05.............0.05\)
\(SO_4^{2-}dư\)
\(m_{\downarrow}=0.05\cdot233=11.65\left(g\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.15.......0.15\)
\(n_{H^+\left(dư\right)}=0.2-0.15=0.05\left(mol\right)\)
\(\left[H^+\right]=\dfrac{0.05}{0.1+0.1+0.1}=\dfrac{1}{6}\)
\(pH=-log\left(\dfrac{1}{6}\right)=0.77\)