Bài 3. (3đ) Cho 276 gam dung dịch K2CO3 10% tác dụng vừa đủ với dung dịch Ba(OH)2 15%.
a. Tính khối lượng dung dịch Ba(OH)2 15% cần dùng.
b. Tính nồng độ % của dung dịch thu được sau phản ứng. (Biết: K=39; C=12; O=16; Ba=137; H=1)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

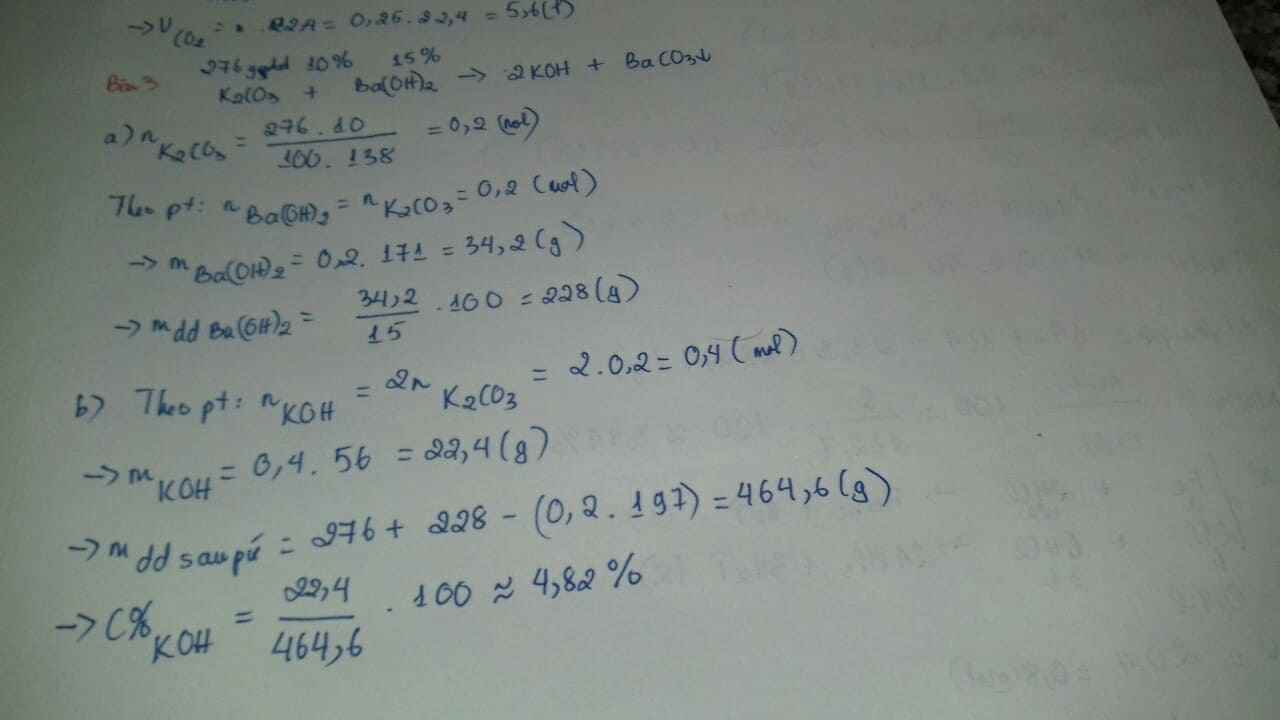

\(n_{Na_2SO_4}=\dfrac{142.10}{100.142}=0,1(mol)\\ Na_2SO_4+Ba(OH)_2\to BaSO_4\downarrow+2NaOH\\ \Rightarrow n_{BaSO_4}=n_{Ba(OH)_2}=0,1(mol);n_{NaOH}=0,2(mol)\\ a,m_{BaSO_4}=0,1.233=23,3(g)\\ b,m_{dd_{Ba(OH)_2}}=\dfrac{0,1.171}{15\%}=114(g)\\ c,C\%_{NaOH}=\dfrac{0,2.40}{142+114-23,3}.100\%=3,44\%\)
Ta có: \(n_{Na_2SO_4}=\dfrac{\dfrac{10\%.142}{100\%}}{142}=0,1\left(mol\right)\)
\(PTHH:Na_2SO_4+Ba\left(OH\right)_2--->BaSO_4\downarrow+2NaOH\)
a. Theo PT: \(n_{BaSO_4}=n_{Ba\left(OH\right)_2}=n_{Na_2SO_4}=0,1\left(mol\right)\)
\(\Rightarrow m_{BaSO_4}=0,1.233=23,3\left(g\right)\)
b. Ta có: \(m_{Ba\left(OH\right)_2}=0,1.171=17,1\left(g\right)\)
Mà: \(C_{\%_{Ba\left(OH\right)_2}}=\dfrac{17,1}{m_{dd_{Ba\left(OH\right)_2}}}.100\%=15\%\)
\(\Leftrightarrow m_{dd_{Ba\left(OH\right)_2}}=114\left(g\right)\)
c. Ta có: \(m_{dd_{NaOH}}=114+14,2-23,3=104,9\left(g\right)\)
Theo PT: \(n_{NaOH}=2.n_{Ba\left(OH\right)_2}=2.0,1=0,2\left(mol\right)\)
\(\Rightarrow m_{NaOH}=0,2.40=8\left(g\right)\)
\(\Rightarrow C_{\%_{NaOH}}=\dfrac{8}{104,9}.100\%=7,63\%\)

Bài 1 :
nNaOH = 0,6 (mol)
NaOH + HCl -> NaCl + H2O
0,6...........0,6........0,6 (mol)
mdd HCl = \(\frac{0,6.36,5}{7,3\%}=300\left(g\right)\)
\(C\%_{NaCl}=\frac{0,6.58,5}{300+200}.100\%=7,02\%\)

a.
\(Na_2CO_3+Ba\left(OH\right)_2\rightarrow BaCO_3+2NaOH\)
b.
\(n_{BaCO_3}=n_{Na_2CO_3}=0,2.1=0,2\left(mol\right)\\ m_{kt}=197.0,2=39,4\left(g\right)\)
c.
\(n_{Ba\left(OH\right)_2}=n_{Na_2CO_3}=0,2\left(mol\right)\\ C\%_{Ba\left(OH\right)_2}=\dfrac{0,2.171.100\%}{200}=17,1\%\)

\(n_{Na_2CO_3}=0,1.1=0,1\left(mol\right)\)
a. \(Na_2CO_3+Ba\left(OH\right)_2\rightarrow BaCO_3+2NaOH\)
0,1 0,1 0,1 0,2
b. \(m_{kt}=m_{BaCO_3}=0,1.197=19,7\left(g\right)\)
c. \(C\%_{Ba\left(OH\right)_2}=\dfrac{0,1.171.100}{200}=8,55\%\)
d. \(BaCO_3+2HCl\rightarrow BaCl_2+H_2O+CO_2\)
0,1 0,2
=> \(a=m_{dd.HCl}=\dfrac{0,2.36,5.100}{30}=\dfrac{73}{3}\left(g\right)\)

\(a.n_{Mg\left(OH\right)_2}=\dfrac{17,4}{58}=0,3\left(mol\right)\\ Mg\left(OH\right)_2+2HCl\rightarrow MgCl_2+2H_2O\\ n_{HCl}=2n_{Mg\left(OH\right)_2}=0,6\left(mol\right)\\ CM_{HCl}=\dfrac{0,6}{0,2}=3M\\b. n_{Mg\left(OH\right)_2}=n_{MgCl_2}=0,3\left(mol\right)\\ m_{MgCl_2}=0,3.85=25,5\left(g\right)\\c.CM_{MgCl_2}=\dfrac{0,3}{0,2}=1,5M \)

a)
$AgNO_3 + HCl \to AgCl + HNO_3$
Theo PTHH :
$n_{AgCl} = n_{HCl} = n_{AgNO_3} = \dfrac{340.10\%}{170} =0,2(mol)$
$m_{dd\ HCl} = \dfrac{0,2.36,5}{7,3\%} = 100(gam)$
b)
$m_{AgCl} = 0,2.143,5 = 28,7(gam)$
c)
$m_{dd\ sau\ pư} = 340 + 100 -28,7 = 411,3(gam)$
$n_{HNO_3} = n_{AgNO_3} = 0,2(mol)$
$\Rightarrow C\%_{HNO_3} = \dfrac{0,2.63}{411,3}.100\% = 3,06\%$

\(n_{CuSO_4}=\dfrac{15,2}{160}=0,095mol\\ CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
0,095 0,19 0,095 0,095
\(m_{rắn}=m_{Cu\left(OH\right)_2}=0,095.98=9,31g\\ V_{ddNaOH}=\dfrac{0,19}{2}=0,095l\\ b)C_{M_{Na_2SO_4}}=\dfrac{0,095}{0,04+0,095}\approx0,7M\\ c)Cu\left(OH\right)_2\xrightarrow[t^0]{}CuO+H_2O\)
0,095 0,095
\(m_{rắn}=m_{CuO}=0,095.80=7,6g\)