Chia 9,6 gam hỗn hợp gồm CuO và Fe2O3 thành hai phần bằng nhau.
Phần 1: Phản ứng với 100 ml dd HCl xM, cô cạn hỗn hợp thu được 8,1 gam chất rắn.
Phần 2: Phản ứng với 200 ml dd HCl xM, cô cạn hỗn hợp thu được 9,2 gam chất rắn. Tìm x và phần trăm khối lượng ủa CuO trong hỗn hợp đầu.

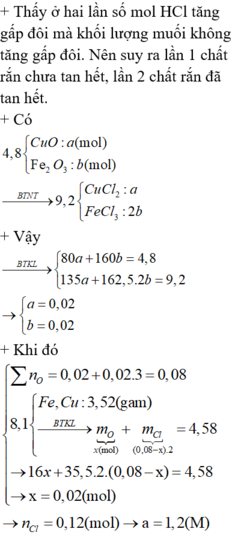



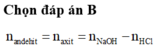

Khối lượng mỗi phần là 4,8 gam.Phần 2 dùng nhiều axit hơn và thu được khối lượng chất rắn nhiều hơn nên phần 1 axit đã phản ứng hết.
Phần 1: nHCl=0,1x➞n\({H_2O}\)=0,05x
mrắn=\(4,8+36,5.0,1x-0,05x.18=8,1\)
➝x=1,2
Phần 2: n\(HCl\)=0,24(mol)
Nếu phần 2 HCl cũng hết thì n\({H_2O}\)=0,12(mol)
➞mrắn=\(4,8+0,24.36,5-0,12.18=11,4>9,2\) : vô lý➞axit còn dư
\(CuO+2HCl-->{CuCl_2}+{H_2O}\)
\(a\) \(a\)
\({Fe_2O_3}+6HCl-->{2FeCl_3}+{3H_2O}\)
b 2b
➝80a+160b=4,8
mrắn=135a+162,5.2b=9,2
➝a=b=0,02
%CuO=33,33%