Cho phản ứng cộng a chứa 300 gam dung dịch HCl 2% và vào góc b chứa 300 gam dung dịch H2 SO4 10% 13,4 gam Fe và Mg lần lượt cho vào các cốc a phản ứng cân có cân bằng không B để cân bằng cần cho nước vào bên nào với khối lượng là bao nhiêu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{HCl}=\dfrac{36,5}{36,5}=1\left(mol\right)\\ n_{Fe}=\dfrac{21}{56}=0,375\left(mol\right)\\ n_{Mg}=\dfrac{21}{24}=0,875\left(mol\right)\)
Xét đĩa cân A:
PTHH: Mg + 2HCl ---> MgCl2 + H2
LTL: \(0,875>\dfrac{1}{2}\) => Mg còn dư
Theo pthh: \(n_{H_2}=\dfrac{1}{2}n_{HCl}=\dfrac{1}{2},1=0,5\left(mol\right)\)
\(\Rightarrow m_A=21+36,5-0,5.2=56,5\left(g\right)\)
Xét đĩa cân B:
PTHH: Fe + 2HCl ---> FeCl2 + H2
LTL: \(0,375< \dfrac{1}{2}\) => HCl dư
Theo pthh: \(n_{H_2}=n_{Fe}=0,375\left(mol\right)\)
\(\Rightarrow m_B=21+36,5-0,375.2=56,75\left(g\right)\)
So sánh: mA < mB
=> mthêm vào đĩa cân A = 56,75 - 56,5 = 0,25 (g)

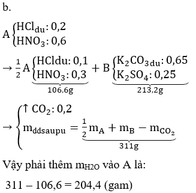
a.
|
|
AgNO3 |
K2CO3 |
| Ban đầu |
0,6 mol; 102 gam |
0,9 mol; 124,2 gam |
| Thêm vào |
→ HCl : 0 , 1 mol ↓ AgCl : 0 , 6 mol |
← H 2 SO 4 : 0 , 25 ↑ CO 2 : 0 , 25 |
| Sau phản ứng |
115,9gam |
213,2 gam |
| Thêm nước |
213,2 – 115,9 = 97,3 gam |
|

PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) (1)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\) (2)
Ta có: \(n_{H_2\left(2\right)}=\dfrac{9,072}{22,4}=0,405\left(mol\right)\) \(\Rightarrow n_{Al}=0,27mol\)
\(\Rightarrow m_1=m_{Al}=0,27\cdot27=7,29\left(g\right)\)
Để 2 đĩa cân bằng \(\Leftrightarrow n_{H_2\left(2\right)}=n_{H_2\left(1\right)}=0,405mol\)
\(\Rightarrow n_{Fe}=0,405mol\) \(\Rightarrow m_2=m_{Fe}=0,405\cdot56=22,68\left(g\right)\)

- Pư xong, trong 2 cốc chỉ thu được dd trong suốt
→ CaCO3 và 2 kim loại A, B tan hết.
Ta có: nCaCO3 = 0,1 (mol) = nCO2
⇒ m cốc 1 tăng = mCaCO3 - mCO2 = 10 - 0,1.44 = 5,6 (g)
Mà: Sau pư khối lượng 2 cốc bằng nhau.
⇒ m cốc 2 tăng = 5,6 (g) = 5,8 - mH2
⇒ mH2 = 0,2 (g) ⇒ nH2 = 0,1 (mol)
Vì: A và B đều thuộc nhóm IA → gọi chung là X.
PT: \(2\overline{X}+2H_2O\rightarrow2\overline{X}OH+H_2\)
Theo PT: \(n_{\overline{X}}=2n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow M_{\overline{X}}=\dfrac{5,8}{0,2}=29\left(g/mol\right)\)
Mà: A và B nằm ở 2 chu kỳ liên tiếp.
⇒ A và B là: Na và K.

- Thí nghiệm 1 : $n_{Mg} = \dfrac{15}{24} = 0,625(mol)$
$Mg + 2HCl \to MgCl_2 + H_2$
Theo PTHH : $n_{H_2} = n_{Mg} = 0,625(mol)$
$\Rightarrow m_{tăng} = m_{Mg} - m_{H_2} = 15 - 0,625.2 = 13,75(gam)$
- Thí nghiệm 2 :
$Fe + H_2SO_4 \to FeSO_4 + H_2$
Theo PTHH : $n_{H_2} = n_{Fe} = \dfrac{a}{56}(mol)$
$m_{tăng} = a - \dfrac{a}{56}.2 = \dfrac{27a}{28}(gam)$
Mà cân ở vị trí cân bằng nên $13,75 = \dfrac{27a}{28} \Rightarrow a = 14,26(gam)$

Ban đầu khi chưa thả 2 kim loại vào thì 2 cốc a,b đặt trên 2 cân a,b ở vị trí thăng bằng. Sau khi tan hết 2 cân ở vị trí thăng bằng.
- Xét cân a:
PTHH: Zn + 2HCl -> ZnCl2 + H2
nZn=26/65=0,4(mol) => \(n_{H_2}=0,4\left(mol\right)\)
- Xét cân b:
PTHH: 2Al +3 H2SO4 -> Al2(SO4)3 +3 H2
Đặt a là số mol của Al. (a>0) (mol)
\(\Rightarrow m_{Al}+m_{ddH_2SO_4}-m_{H_2\left(b\right)}=m_{Zn}+m_{ddHCl}-m_{H_2\left(a\right)}\\ Mà:m_{ddH_2SO_4}=m_{ddHCl}\\ \Leftrightarrow m_{Al}-m_{H_2\left(b\right)}=m_{Zn}-m_{H_2\left(a\right)}\\ \Leftrightarrow27a-1,5a.2=26-0,4.2\\ \Leftrightarrow a=\dfrac{25,2}{24}=1,05\left(mol\right)\\ \Rightarrow m_{Al}=1,05.27=28,35\left(g\right)\\ \Rightarrow m=28,35\left(g\right)\)