cho 16 g hỗn hợp gồm MgO và Fe2O3 tan hết trong 0,5 lít dung dịch H2SO4 sau phản ứng, trung hòa axit còn dư bằng 50 gam dung dịch NaOH 24% . Tính phần trăm khối lượng mỗi oxit trong hỗn hợp ban đầu?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


PT: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\left(1\right)\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\left(2\right)\)
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT (1): \(n_{Mg}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Mg}=0,1.24=2,4\left(g\right)\)
\(\Rightarrow m_{MgO}=m_{hh}-m_{Mg}=4,4-2,4=2\left(g\right)\)
Bạn tham khảo nhé!

PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)=n_{Mg}\)
\(\Rightarrow m_{Mg}=0,1\cdot24=2,4\left(g\right)\) \(\Rightarrow m_{MgO}=2\left(g\right)\)

Pt : \(MgO+H_2SO_4\rightarrow MgSO_4+H_2O|\)
1 1 1 1
a 1a 0,05
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O|\)
1 3 1 3
b 3b 0,05
Gọi a là số mol của MgO
b là số mol của Fe2O3
\(m_{MgO}+m_{Fe2O3}=10\left(g\right)\)
⇒ \(n_{MgO}.M_{MgO}+n_{Fe2O3}.M_{Fe2O3}=10g\)
⇒ 40a + 160b = 10g (1)
\(m_{ct}=\dfrac{5,6.350}{100}=19,6\left(g\right)\)
\(n_{H2SO4}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
⇒ 1a + 6b = 0,2(2)
Từ(1),(2) , ta có hệ phương trình :
40a + 160b = 10
1a + 6b = 0,2
⇒ \(\left\{{}\begin{matrix}a=0,05\\b=0,05\end{matrix}\right.\)
\(m_{MgO}=0,05.40=2\left(g\right)\)
\(m_{Fe2O3}=0,05.160=8\left(g\right)\)
0/0MgO = \(\dfrac{2.100}{10}=20\)0/0
0/0Fe2O3 = \(\dfrac{8.100}{10}=80\)0/0
b) Có : \(n_{MgO}=0,05\left(mol\right)\Rightarrow n_{MgSO4}=0,05\left(mol\right)\)
\(n_{Fe2O3}=0,05\left(mol\right)\Rightarrow n_{Fe2\left(SO4\right)3}=0,05\left(mol\right)\)
\(m_{MgSO4}=0,05.161=8,05\left(g\right)\)
\(m_{Fe2\left(SO4\right)3}=0,05.400=20\left(g\right)\)
Chúc bạn học tốt

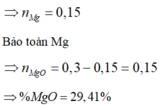
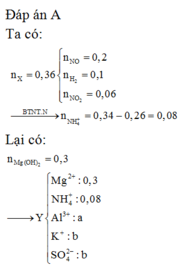

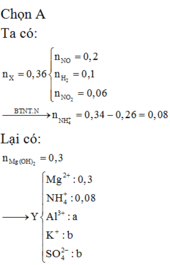

Đề của bạn còn thiếu thì phải, bạn kiểm tra lại nha