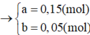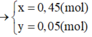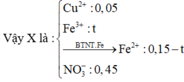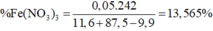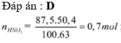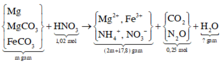Cho V lit khí Clo (đktc) phản ứng hết với m gam hỗn hợp Mg và Fe( có cùng số mol) thu được hỗn hợp chất rắn A. A tan hoàn toàn trong nước tạo thành dd B. Cô cạn B được 23,975 gam hỗn hợp chất rắn khan C. Để phản ứng vừa đủ với các chất trong C cần dung dịch 15,8 gam KMnO4( có mặt H2SO4 dư). Xác định giá trị của m và V
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
, mtăng = mSO4 muối = 7,04g
=> bảo toàn nguyên tố : nH2SO4 pứ = nSO4 muối + nSO2 = 0,1133 mol

Đáp án D
, mtăng = mSO4 muối = 7,04g
=> bảo toàn nguyên tố : nH2SO4 pứ = nSO4 muối + nSO2 = 0,1133 mol

Đáp án : B
Vì kim loại tan hết nên HNO3 dư
Khi X + KOH => thu được kết tủa
+) Giả sử KOH dư => chất rắn 16,0g gồm Fe2O3 ; CuO (*)
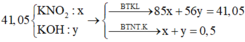
Khi đó T gồm KNO3 và KOH => Nung lên thành KNO2 và KOH với số mol lần lượt là x và y
=> 41,05 = 85x + 56y
Và nK = 0,5 = x + y
=> x = 0,45 mol ; y = 0,05 mol
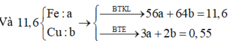
Gọi số mol Fe và Cu trong A lần lượt là a và b mol
=> 56a + 64b = 11,6g
Và 80a + 80b = 16g (*)
=> a = 0,15 mol ; b = 0,05 mol
+) Nếu chỉ có Fe3+ và Cu2+ => nKOH < 3nFe + 2nCu ( Vô lí )
=> Trong X có Fe2+ : u mol và Fe3+ : v mol
=> HNO3 phải hết
=> u + v = 0 , 15 2 u + 3 v = 0 , 45 => u = 0 , 1 v = 0 , 05
Có nFe(NO3)3 = 0,05 mol
Ta thấy mN2 < mB < mNO2
=> 0,35.28 < mB < 46.0,7
=> 9,8 < mB < 32,2g
BTKL : 66,9g < mdd sau < 89,3g
=> 13,55% < %mFe(NO3)3 < 18,09%

Gọi \(\left\{{}\begin{matrix}n_{H_2}=a\left(mol\right)\\n_{CO_2}=b\left(mol\right)\end{matrix}\right.\) => \(a+b=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
=> \(\overline{M}_X=\dfrac{2a+44b}{a+b}=2.6,25=12,5\left(g/mol\right)\)
=> a = 0,3; b = 0,1
PTHH: Fe + 2HCl --> FeCl2 + H2
0,3<--0,6<------0,3<---0,3
CaCO3 + 2HCl --> CaCl2 + CO2 + H2O
0,1<----0,2<------0,1<----0,1
CuO + 2HCl --> CuCl2 + H2O
x--->2x------->x
mrắn (sau pư) = 0,3.127 + 0,1.111 + 135x = 62,7
=> x = 0,1 (mol)
mA = 0,1.80 + 0,3.56 + 0,1.100 = 34,8 (g)
mHCl = (0,6 + 0,2 + 0,2).36,5 = 36,5 (g)
=> \(m'=\dfrac{36,5.100}{14,6}=250\left(g\right)\)