21. Khi tăng nhiệt độ từ 60o C lên 100o C, vận tốc của phản ứng tăng lên 81 lần. Tính năng lượng hoạt hoá của phản ứng theo phương trình Arrhenius. Cho biết R = 8,314 J/K.mol.
22. Tốc độ phản ứng đơn giản: H2 (k) + I2 (k) à 2HI (k)thay đổi như thế nào khi giảm thể tích hỗn hợp khí 5 lần mà vẫn giữ nguyên nhiệt độ?
23. Một phản ứng có tốc độ phản ứng ở ở 50o C là 10−5 mol/l.s; ở 100o C, tốc độ phản ứng bằng 10−2 mol/l.s. Tính năng lượng hoạt hóa dựa vào phương trình Arrhenius. Cho biết R = 1,987 cal/mol.K.
chỉ giáu các bấc

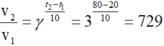


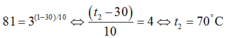
Câu 21, 23: Em thay dữ kiện vào công thức:
\(ln\frac{k_1}{k_2}=\frac{-E_a}{R}.\left(\frac{1}{T_1}-\frac{1}{T_2}\right)\)
Câu 22: không đổi do tốc độ pứ hệ không phụ thuộc vào thể tích hỗn hợp.