11 / Hòa tan hoàn toàn 19,5 gam một kim loại M trong dung dịch HCl vừa đủ thì thu được 40,8 gam muối . Tìm kim loại M. ( Biết M có hóa trị từ I-III
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1/ PT : X + 2H2O -> X[OH]2 + H2
mol : \(\frac{6}{M_X}\) -> \(\frac{6}{M_X}\)
=> mH2 = \(\frac{12}{M_X}\) => mdd = m+6 - \(\frac{12}{M_X}\)
Ta có: m+5,7 = m+6 - \(\frac{12}{M_X}\)
<=> \(\frac{12}{M_X}\)= 0,3 => MX = 40 => X là Canxi [Ca]
2/ Dặt nHCl= a [a> 0] => mddHCl= 36,5a : 14,6 x 100= 250a
PT : X + 2HCL => XCl2 + H2
mol : a/2 a -> a/2 a/2
mH2 = a/2 x 2 = a ; mX = a/2 . MX
m XCl2= a/2 x [MX +71]
mdd XCL2= a/2 .MX + 250a - a = a/2 .MX +249a
Ta có :\(\frac{\frac{a}{2}\times M_X+\frac{71}{2}a}{M_X\times a:2+249a}\times100\%=24,15\%\)
<=> \(\frac{M_X+71}{M_X+498}=24,15\%\Leftrightarrow M_X=65\)=> X là kẽm [Zn]

\(a,n_A=\dfrac{2,7}{M_A}\left(mol\right)\\ n_{ACl_3}=\dfrac{13,35}{M_A+106,5}\)
PTHH: \(2A+6HCl\rightarrow2ACl_3+3H_2\)
\(\dfrac{2,7}{M_A}\)-------------->\(\dfrac{2,7}{M_A}\)
\(\rightarrow\dfrac{2,7}{M_A}=\dfrac{13,35}{M_A+106,5}\\ \Leftrightarrow M_A=27\left(g\text{/}mol\right)\)
=> A là Al
\(b,n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: \(2M+2nHCl\rightarrow2MCl_n+nH_2\) (n là hoá trị của M, n ∈ N*)
\(\dfrac{0,4}{n}\)<---------------------------0,2
\(\rightarrow M_M=\dfrac{4,8}{\dfrac{0,2}{n}}=12n\left(g\text{/}mol\right)\)
Vì n là hoá trị của M nên ta có bảng
| n | 1 | 2 | 3 |
| MM | 12 | 24 | 36 |
| Loại | Mg | Loại |
Vậy M là Mg

2 M + 2 n H C l → 2 M C l n + n H 2
2/n <…...2 ………..mol
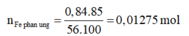
Vậy
⇒ n H 2 = n F e p ư = 0,01275 mol
⇒ V H 2 = 0,01275.22,4 = 0,2856 mol
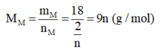
Nếu n = 1 thì M M = 9 → loại
Nếu n = 2 thì M M = 18 → loại
Nếu n = 3 thì M M = 27 → M là kim loại Al
⇒ Chọn C.

Gọi hóa trị của R là n và số mol Sn và R lần lượt là a và b mol
+/ Khi phản ứng với HCl :
Sn + HCl → SnCl2 + H2
R + nHCl → RCln + 0,5nH2
+/ Khi đốt trong oxi :
Sn + O2 → SnO2
2R + 0,5nO2 → R2On
=> Ta có : nH2 = a + 0,5nb = 0,225 mol
Và nO2 = a + 0,25nb = 0,165 mol
=> a = 0,105 mol ; nb = 0,24 mol
Có mmuối = 0,105.190 + 0,24/n . (R + 35,5n) = 36,27
=>R = 32,5n
=>Cặp n =2 ; R =65 (Zn) thỏa mãn
=>B

Đặt kim loại M có hóa trị n khi phản ứng với 100g dung dịch HCl 20%
\(n_{HCl}=\dfrac{100.20\%}{36,5}=\dfrac{40}{73}\left(mol\right)\)
\(2M+2nHCl\rightarrow2MCl_n+nH_2\)
\(\dfrac{40}{73n}\)<----\(\dfrac{40}{73}\)-------> \(\dfrac{40}{73n}\)---> \(\dfrac{20}{73}\) (mol)
Theo ĐLBTKL :
=> \(m_{ddMCl_n}=\dfrac{40}{73n}.M+100-\dfrac{20}{73}.2=\dfrac{40.M}{73n}+\dfrac{7260}{73}\left(g\right)\)
\(C\%_{MCl_n}=\dfrac{\dfrac{40}{73n}.\left(M+35,5.n\right)}{\dfrac{40M}{73n}+\dfrac{7260}{73}}.100=23,36\)
Lập bảng :
| n | 1 | 2 | 3 |
| M | 9 | 18 | 27 |
| Kết luận | Loại | Loại | Chọn (Al) |
Vậy kim loại cần tìm là Nhôm (Al)
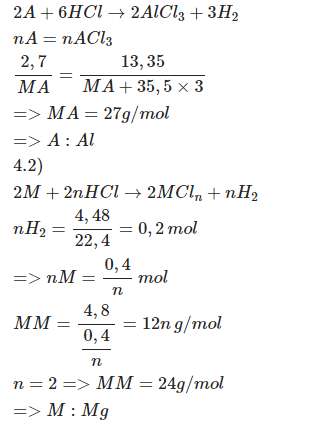

Gọi hóa trị của M là n
\(\Rightarrow n_M=\dfrac{19,5}{M}\\ n_{MCl_n}=\dfrac{40,8}{M+35,5n}\)
\(PTHH:M+nHCl\rightarrow MCl_n+\dfrac{n}{2}H_2\\ TL:.....1...............1....\\ BR:.....\dfrac{19,5}{M}........\dfrac{40,8}{M+35,5n}.....\left(mol\right)\)
\(\Rightarrow\dfrac{19,5}{M}=\dfrac{40,8}{M+35,5n}\\ \Rightarrow40,8M=19,5M+692,25n\\ \Rightarrow21,3M=692,25n\\ \Rightarrow M=32,5n\)
Với \(n=2\) thì \(M=65\left(tm\right)\)
Vậy M là Zn