Tính khối lượng KMnO4 cần dùng để điều chế 16,8 lít O2 (đktc), biết hiệu suất phản ứng là 90% và lượng O2 hao hụt 10%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
\(n_{KClO_3}=\dfrac{24.5}{122.5}=0.2\left(mol\right)\)
\(2KClO_3\underrightarrow{^{^{t^0}}}2KCl+3O_2\)
\(n_{O_2}=\dfrac{3}{2}\cdot0.2=0.3\left(mol\right)\)
\(V_{O_2}=0.3\cdot22.4=6.72\left(l\right)\)
\(n_{O_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(2KMnO_4\underrightarrow{^{^{t^0}}}K_2MnO_4+MnO_2+O_2\)
\(0.2...............................................0.1\)
\(n_{KMnO_4\left(bđ\right)}=\dfrac{0.2}{90\%}=\dfrac{2}{9}\left(mol\right)\)
\(m_{KMnO_4}=\dfrac{2}{9}\cdot158=35.11\left(g\right)\)

nO2 (TT) = 11,2/22,4 = 0,5 (mol)
nO2 (LT) = 0,5/80% = 0,625 (mol)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 0,625 . 2 = 1,25 (mol)
mKMnO4 = 1,25 . 158 = 197,5 (g)
\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{11,2}{22,4}=0,5mol\)
\(2KMnO_4\rightarrow\left(t^o\right)K_2MMnO_4+MnO_2+O_2\)
1 0,5 ( mol )
\(n_{KMnO_4}=\dfrac{1}{80\%}=1,25mol\)
\(m_{KMnO_4}=n_{KMnO_4}.M_{KMnO_4}=1,25.158=197,5g\)

\(n_{Al}=\dfrac{5.4}{27}=0,2mol\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
0,2 0,15 0,1
a)\(V_{O_2}=0,15\cdot22,4=3,36l\)
b)\(n_{O_2}=0,15\cdot10\%=0,015mol\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,03 0,015
\(m_{KMnO_4}=0,03\cdot158=4,74g\)

\(n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
1<------------------------------------0,5
=> \(m_{KMnO_4\left(pthh\right)}=1.158=158\left(g\right)\)
=> \(m_{KMnO_4\left(tt\right)}=\dfrac{158.100}{80}=197,5\left(g\right)\)

PT: \(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
Ta có: \(n_{Cl_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{KMnO_4\left(LT\right)}=\dfrac{2}{5}n_{Cl_2}=0,2\left(mol\right)\\n_{HCl\left(LT\right)}=\dfrac{16}{5}n_{Cl_2}=1,6\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{KMnO_4\left(LT\right)}=0,2.158=31,6\left(g\right)\\V_{ddHCl\left(LT\right)}=\dfrac{1,6}{2}=0,8\left(l\right)\end{matrix}\right.\)
Mà: H% = 75%
\(\Rightarrow\left\{{}\begin{matrix}m_{KMnO_4\left(TT\right)}=\dfrac{31,6}{75\%}\approx42,13\left(g\right)\\V_{ddHCl\left(TT\right)}=\dfrac{0,8}{75\%}\approx1,067\left(l\right)\end{matrix}\right.\)
Bạn tham khảo nhé!

Bài 4. 2\(KMnO_4\) ---> \(K_2MnO_4\) + \(MnO_2\) + \(O_2\) (Lập và cân bằng phương trình)
0,6 mol 0,3 mol 0,3 mol 0,3 mol
a. + Số mol của \(O_2\)
\(n_{O_2}\) = \(\dfrac{V}{22,4}\) = \(\dfrac{6,72}{22,4}\) = 0,3 (mol)
+ Khối lượng của \(KMnO_4\) (thuốc tím) cần dùng:
\(m_{KMnO_4}\) = n . M = 0,6 . 158 = 94,8 (g)
b. 2\(KClO_3\) ---> 2\(KCl\) + 3\(O_2\) (Lập và cân bằng phương trình)
0,2 mol 0,2 mol 0,3 mol
Số g \(KClO_3\) dùng để điều chế:
\(m_{KClO_3}\) = n . M = 0,2 . 122,5 = 24,5 (g)
c. 2Cu + \(O_2\) ---> 2\(CuO\) (Lập và cân bằng phương trình)
0,6 mol 0,3 mol 0,6 mol
Số g của CuO sau phản ứng thu được:
\(m_{CuO}\) = n . M = 0,6 . 80 = 48 (g)
________________________________________
Bài 4 trước nha bạn, có gì sai thì nhắn mình :))
Bài 5. CuO + \(H_2\) ---> Cu + \(H_2O\) (Lập và cân bằng phương trình)
0,2 mol 0,2 mol 0,2 mol 0,2 mol
a. + Số mol của CuO:
\(n_{CuO}\) = \(\dfrac{m}{M}\) = \(\dfrac{16}{80}\) = 0,2 (mol)
+ Thể tích của \(H_2\)
\(V_{H_2}\) = n . 22,4 = 0,2 . 22,4 = 4,48 (lít)
b. Khối lượng Cu sau phản ứng:
\(m_{Cu}\) = n . M = 0,2 . 64 = 12,8 (g)
______________________________
Bài 5 nha, sai thì nhắn mình :))

a) $n_{Al} = \dfrac{5,4}{27} = 0,2(mol)$
$4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3$
$n_{O_2} = \dfrac{3}{4}n_{Al} = 0,15(mol)$
$V_{O_2} = 0,15.22,4 = 3,36(lít)$
b) $2KClO_3 \xrightarrow{t^o,MnO_2} 2KCl + 3O_2$
$n_{KClO_3\ pư} = \dfrac{2}{3}n_{O_2} = 0,1(mol)$
$m_{KClO_3\ pư} = 0,1.122,5 = 12,25(gam)$
$\Rightarrow m_{KClO_3\ đã\ dùng} = 12,25 : (100\% - 10\%) = 13,61(gam)$
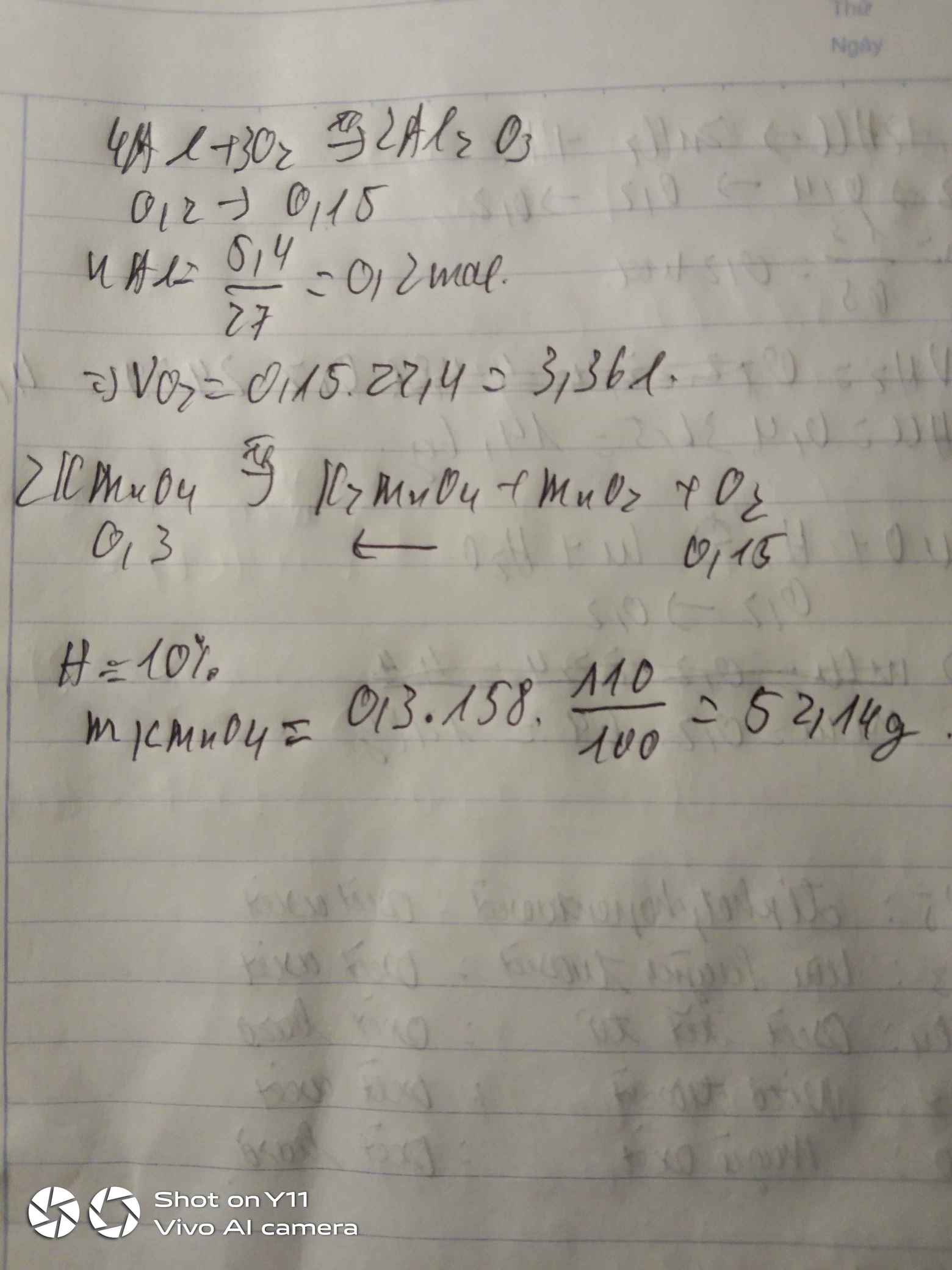
2KMnO4 -> O2
nO2 = 0,75 mol
Lượng oxi hao hụt 10% => nKMnO4 = (2×0,75×100)/(100-10) = 5/3 mol
Hiệu suất 90% => nKMnO4 thực tế = (5/3×100)/90 = 50/27 mol => mKMnO