10. Để hoà tan hoàn toàn 16,1g hỗn hợp gồm MgO và ZnO cần dùng hết 250 ml dung dịch HCl aM. Sau phản ứng thu đc dd Z . Cô cạn dd Z thu đc 32,6g muối khan. Giá trị V là?
34. Để hoà tan hết 12g một oxit kim loại M hoá trị II cần dùng vừa đủ 250ml dd HCl 2,4M. Kim loại M là?
35. Để hoà tan hết 16,32g một oxit kim loại R( chưa rõ hoá trị) cần dùng hết 150g dd HCl 23,36%. Kim loại R là?





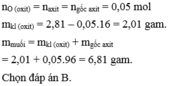


Câu 10:
\(MgO+2HCl\rightarrow MgCl_2+H_2\)
x______2x______x_______
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\)
y_______2y______y________
Giải hệ PT
\(\left\{{}\begin{matrix}40x+81y=16,1\\95x+136y=32,6\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(\Rightarrow n_{HCl}=0,4+0,2=0,6\left(mol\right)\)
\(\Rightarrow a=\frac{0,6}{0,25}=2,4M\)
Câu 34:
Công thức của oxit có dạng MO
\(n_{HCl}=0,6\left(mol\right)\)
\(PTHH:MO+2HCl\rightarrow MCl_2+H_2O\)
______0,3 _______0,6_____________
\(n_{MO}=0,3\left(mol\right)\)
\(M=\frac{12}{0,3}=40\)
Ta có:
40=M của M+M O
40=M của M+16
\(\Rightarrow M_M=24\left(Mg\right)\)
Vậy kim loại M là Mg
Câu 3:
Ta có:
\(n_{HCl}=0,86\left(mol\right)\)
\(R_xO_y+2yHCl\rightarrow xRCl_{\frac{2y}{x}}+yH_2O\)
\(\Rightarrow n_{RxOy}=\frac{0,86}{2y}\left(mol\right)\)
\(\Leftrightarrow m_{RxOy}=34y\)
Lập bảng biện luận tìm được R là Al