Điện phân 200 ml dung dịch CuSO4 với I = 1,93 A tới khi catot bắt đầu có bọt khí thoát ra thì dừng lại, cần thời gian là 250 giây. Thể tích khí thu được ở anot (đktc) là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Tới khi catot có bọt khí (H2), CuSO4 đã bị điện phân hết vì khi đó nước bị điện phân. Khí thoát ra ở anot khi điện phân CuSO4 là O2.
\(CuSO_4+H_2O\underrightarrow{^{đpdd}}Cu+H_2SO_4+\frac{1}{2}O_2\)
Gọi x là mol Cu tạo thành
\(\Rightarrow64x=\frac{64.1,93.250}{2.96500}\)
\(\Rightarrow n_{Cu}=2n_{O2}=0,0025\left(mol\right)\)
\(\Rightarrow V_{O2}=\frac{0,0025.22,4}{2}=0,028\left(l\right)\)

Đáp án : A
Do ngừng đến khi catot xuất hiện khí nên :
Catot : Cu2+ + 2e à Cu
Anot : 2Cl- à Cl2 + 2e
2H2O 4H+ + O2 + 4e
Bảo toàn e : 2nCu2+ = nCl- + 4nO2 => nO2 = 0,02 mol
=> nkhí = nCl2 + nO2 = 0,08 mol => Vkhí = 1,792 lit

Đáp án C
Ở t giây ta thu được ở anot 0,12 mol hỗn hợp khí gồm Cl2 và O2.
Ở 2t giây ta thu được thể tích khí ở anot gấp 3 lần ở catot.
Goi số mol Cl2 và O2 ở t giây lần lượt là a, b
=> a+b=0,12
Bảo toàn e: n e = 2 a + 4 b
Lúc 2t giây: n e = 4 a + 8 b
Lúc này ở anot thu được Cl2 a mol và O2 → n O 2 = 4 a + 8 b - 2 a 4 = 0 , 5 a + 2 b
Do vậy ở catot thu được là H2 với số mol H2 = 0 , 5 a + 2 b + a 3 = 0 , 5 a + 2 b 3
Bảo toàn e:
n C u 2 + = 2 a + 4 ( 0 , 5 a + 2 b ) - 2 ( 0 , 5 a + 2 b 3 ) 2 = 1 , 5 a + 10 b 3 → 64 ( 1 , 5 a + 10 b 3 ) = 18 , 56
Giải hệ: a = b = 0,06 mol
Do vậy số mol KCl là 0,12 mol và CuSO4 là 0,29 mol.
m = 55,54 gam.

Chọn đáp án A.
Đặt số mol của CuSO4 và KCl lần lượt là x, y.
Phương trình điện phân:
Catot: Cu2+ +2e → Cu
2H2O + 2e → 2OH- + H2
Anot: 2Cl- → Cl2 + 2e
2H2O → 4H+ + 4e + O2
Điện phân t giây:
0 , 5 y + n O 2 t = 2 , 688 22 , 4 = 0 , 12 m o l
⇒ n O 2 t = 0 , 12 - 0 , 5 y
=> nđiện phân = y + 4 . 0 , 12 - 0 , 5 y = 0 , 48 - y
Điện phân 2t giây:
nđiện phân = 2 . 0 , 48 - y mol
⇒ n O 2 2 t = 0 , 24 - 0 , 75 y mol
mcatot tăng = 64 x = 18 , 56 ⇒ x = 0 , 29
⇒ n H 2 = 019 - y
⇒ m = 160 x + 74 , 5 y = 55 , 34 g

Đáp án C
Ở t giây ta thu được ở anot 0,12 mol hỗn hợp khí gồm Cl2 và O2.
Ở 2t giây ta thu được thể tích khí ở anot gấp 3 lần ở catot.
Goi số mol Cl2 và O2 ở t giây lần lượt là a, b => a + b = 0,12
Bảo toàn e: n e = 2a + 4b
Lúc 2t giây: n e = 4a + 8b
Lúc này ở anot thu được Cl2 a mol và O2
Do vậy ở catot thu được là H2 với số mol H2
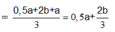
Bảo toàn e: n C u 2 +
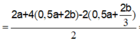
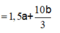
![]()
Giải hệ: a = b = 0,06 mol
Do vậy số mol KCl là 0,12 mol và CuSO4 là 0,29 mol.
m = 55,54 gam.


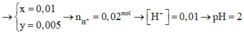
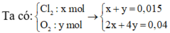
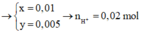
ne trao đổi = I.t / F = 0,005 mol
Ở catot: Cu2+ + 2e → Cu
Ở anot: 2H2O → 4H+ + O2 + 4e
Ở catot bắt đầu có bọt khí thoát ra => Cu2+ điện phân vừa hết
=> nO2 thu được ở anot = 0,005 / 4 = 0,00125 mol
=> V = 0,028 lít = 28 ml
Khí ở anot là O2
\(CuSO_4+H_2O\rightarrow Cu+H_2SO_4+\frac{1}{2}O_2\)
Gọi \(n_{Cu}:x\left(mol\right)\)
\(\Rightarrow64x=\frac{64.1,93.250}{2.96500}\Rightarrow x=2,5.10^{-3}\)
\(\Rightarrow n_{O2}=1,25.10^{-3}\)
\(\Rightarrow V_{O2}=22,4.1,25.10_3=0,028\left(l\right)=28\left(ml\right)\)