Cho 7,2 gam hỗn hợp M gồm 2 muối cabonat của 2 kim loại kế tiếp nhau trong nhóm IIA. Hòa tan hết M trong dd H2SO4 loãng thu được khí CO2. Hấp thụ toàn bộ khí CO2 vào trong 450ml dd Ba(OH)2 0,2M thu được 15,76 gam kết tủa. Xác định công thức của 2 muối cacbonat?
giúp mình với ạ.

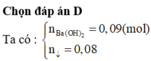

\(n_{Ba\left(OH\right)2}=0,09\left(mol\right)\)
\(n_{BaCO3}=0,08\left(mol\right)\)
- TH1: dư kiềm
\(\Rightarrow n_{CO2}=n_{CaCO3}=0,08\left(mol\right)\)
Bảo toàn C: \(n_M=n_{CO2}=0,08\left(mol\right)\)
\(\Rightarrow\overline{M_M}=\frac{7,2}{0,08}=90\Rightarrow R+60\)
\(\Rightarrow R=30\)
Vậy 2 muối cacbonat là MgCO3 và CaCO3
- TH2: dư CO2
\(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3+H_2O\)
=> Tạo 0,09 mol BaCO3. Có 0,09 mol CO2 tạo kết tủa.
=> Có 0,09-0,08= 0,01 mol BaCO3 tan.
\(BaCO_3+CO_2+H_2O\rightarrow Ba\left(HCO_3\right)_2\)
\(\Rightarrow n_{CO2}=n_{BaCO3\left(tan\right)}=0,01\left(mol\right)\)
\(\Rightarrow\Sigma n_{CO2}=0,1\left(mol\right)=n_M\)
\(\Rightarrow\overline{M_M}=72=R+60\)
\(\Rightarrow R=12\)
Vậy 2 muối cacbonat là BeCO3 và MgCO3
ACO3 +H2SO4-----CO2
CO2 +Ba(OH)2-----BaCO3 (1) CO2+Ba(OH)2---------Ba(HCO3)2 (2)
n(kết tủa)=0.08 n(kiềm)=0.09
th1:Ba(OH)2 dư xảy ra (1) (2)
n(CO2)=0.08+0.02=0.1
Suy ra n(CO2)=n(ACO3)=0.1 SUY RA M(ACO3)=7.2/0.1=72 suy ra A=12 nằm gữa 9(Be) và 24(Mg)
th2: Ba(OH)2 thiếu suy ra n(CO2)=n(kết tủa)=0.08 suy ra M(ACO3)=7.2/0.08=90 SUY RA A=30 nằm giữa Mg VÀ Ca
Lập hệ pt ta tìm được % : T.hợp 1 :BeCO3,MgCO3 (76,6%,23,3%);T.hợp 2 :MgCO3,CaCO3 (58,33%,41,67,)